
【题目】下列反应中反应物总能量低于生成物总能量的是( )
A. 乙醇燃烧 B. 碳酸钙分解 C. 铝粉与氧化铁粉末反应 D. 氧化钙溶于水
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )

A. 在t℃时,Ag2CrO4的Ksp为1×10-8
B. 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C. 在t℃时,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D. 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法” 生产纯碱和化肥NH4Cl,工艺流程如下图所示.下列有关说法正确的是
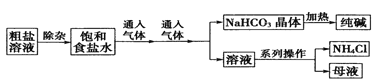
A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的下列说法中正确的是( )
A.晶体中分子间作用力越大,分子越稳定
B.冰熔化时水分子中共价键发生断裂
C.原子晶体中共价键越强,熔点越高
D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关含高能量的正离子N5+的化合物N5AsF6的叙述正确的是( )
A.N5+与H2S是等电子体
B.N5AsF6化合物是共价分子
C.N5+中氮氮原子间以共用电子对结合
D.N5AsF6化合物是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果ag某气体中含有的分子数为b,则cg该气体的物质的量是( )
A. bc/(aNA)mol B. ac/(bNA)mol C. ab/(cNA)mol D. b/(acNA)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B. 醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C. 在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
D. 在NaHCO3溶液中滴入少量澄清石灰水:HCO![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
(1)已知:①CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g) ![]() CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g) ![]() 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为_________。
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol·L-1 | H2O初始浓度/mol·L-1 |
1 | 400 | P | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2______K3(填“>”、“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为________。
(3)科学家提出由CO2制取C的太阳能工艺如图1所示。
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则FexOy的化学式为______________。
②“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________。

(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题(若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-_____________(填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________。
③人体血液里主要通过碳酸氢盐缓冲体系c(H2CO3)/c(HCO3-)可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将_______。
A.变大 B.变小 C.基本不变 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com