
��12�֣��㶹����һ����Ȼ���ϣ������ں��㶹��������ֲ���С���ҵ�ϳ���ˮ��ȩ���������ڴ��������¼��ȷ�Ӧ�Ƶã�

�������ɼױ�Ϊԭ�������㶹�ص�һ�ֺϳ�·�ߣ����ַ�Ӧ����������������ȥ��
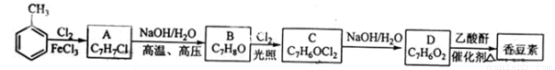
��֪������Ϣ��
��A�������ֲ�ͬ��ѧ�������⣻
��B����FeCl3��Һ������ɫ��Ӧ��
��ͬһ��̼ԭ�������������ǻ�ͨ�����ȶ�������ˮ�γ��ʻ���
��ش��������⣺
��1��A�Ļ�ѧ����Ϊ__________��
��2���㶹�صķ���ʽΪ_______���ɼױ�����A�ķ�Ӧ����Ϊ___________��
��3��B��ͬ���칹���к��б����Ļ���_____�֣������ں˴Ź���������ֻ������������_____�֣�
��4����B����C�Ļ�ѧ��Ӧ����ʽΪ___________��
��5��D��ͬ���칹���к��б����Ļ���______�֣����У����ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ����________��д�ṹ��ʽ����
��1��2-�ȼױ��������ȼױ���
��2��C9H6O2��ȡ����Ӧ��
��3��4��2
��4��
��5��4��
��������
�����������1��A�ɼױ�ȡ����Ӧ���ɣ�A�������ֲ�ͬ��ѧ�������⣬����Ϊ2-�ȼױ��������ȼױ�����
��2�����㶹�ؽṹ��ʽ�������ʽΪC9H6O2��A�ɼױ���Cl2�����Ȼ����������·���ȡ����Ӧ���ɣ�
��3��BΪ ��ͬ���칹���к��б����Ļ���
��ͬ���칹���к��б����Ļ��� ��4��
��4��
�������ں˴Ź���������ֻ������������2�֡�
��4����B����C�ڼ��Ϸ���ȡ����ӦΪ
��5��DΪ ����ͬ���칹���к��б����Ļ���
����ͬ���칹���к��б����Ļ��� ��4�֣����ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ����
��4�֣����ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ����
���㣺�������������ӡ�ȩ�����ʵ����ʣ��л���ͬ���칹�塣


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ�ڵ�����ͳ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�CO2��Ϊδ��̼Դ���ȿ��ֲ���ʯ�͡���Ȼ���ȴ�����������ġ�̼ԴΣ�������ֿ���Ч�ؽ������ЧӦ����ش��������⣺
��1��������CH4��H2O(g)ͨ��۽�̫���ܷ�Ӧ����������ӦCH4(g)+H2O(g) CO(g)+3H2(g) ��H = +206 kJ��mol-1���������ʵ�����CH4��H2O(g)����2 L�����ܱ�������ij�¶��·�Ӧ5 min��ﵽƽ�⣬��ʱ���CO�����ʵ���Ϊ0.10 mol����5 min��H2��ƽ����Ӧ����Ϊ ��ƽ�����Բ�ȡ���� �Ĵ�ʩ��ʹn��CO����n��CH4������
CO(g)+3H2(g) ��H = +206 kJ��mol-1���������ʵ�����CH4��H2O(g)����2 L�����ܱ�������ij�¶��·�Ӧ5 min��ﵽƽ�⣬��ʱ���CO�����ʵ���Ϊ0.10 mol����5 min��H2��ƽ����Ӧ����Ϊ ��ƽ�����Բ�ȡ���� �Ĵ�ʩ��ʹn��CO����n��CH4������
A�����������¶�
B�����º����³��뺤��
C�������������������
D�����º������ٳ�������ʵ�����CH4��H2O
��2����ҵ�Ͽ�������COΪԭ����ȡCH3OH��
��֪:CO2(g)+3H2(g) CH3OH(g) +H2O(g) ��H=-49.5 kJ��mol��1
CH3OH(g) +H2O(g) ��H=-49.5 kJ��mol��1
CO2��g��+H2��g�� CO��g��+H2O��g�� ��H= + 41.3 kJ��mol��1
CO��g��+H2O��g�� ��H= + 41.3 kJ��mol��1
����д����CO��H2��ȡ�״����Ȼ�ѧ����ʽ ��
�ڸ÷�Ӧ�ġ�S 0(�>����<����=��)���� ����������ڸ÷�Ӧ�Է����С�
��3��ij������ԱΪ�о�H2��CO�ϳ�CH3OH�������ʼ��ɱ�n(H2) �� n(CO)����l L�����ܱ�������ͨ��H2��CO�Ļ������CO��Ͷ������Ϊ1 mol�����ֱ���230��C��250��C��270��C����ʵ�飬��ý������ͼ����230��ʱ��ʵ��������Ӧ�������� (����ĸ)�������� ����ʽ����270��ʱ�÷�Ӧ��ƽ�ⳣ��K�� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ��о�����������ѧ����ĩ��ѧ������⻯ѧ�Ծ��������棩 ���ͣ������
���ǵڶ��������ǵؿ��к������Ľ�������;�㷺��
51��1.��ij��������R(Al2O3��Fe2O3)��ĩ48.8g���뺬1mol NaOH����Һ�У������ķ�ӦΪ��
Al2O3(s)+2NaOH(aq)+ 2H2O(l)��2NaAl(OH)4(aq)
��ַ�Ӧ���ˡ�ϴ�ӡ�����õ�8.0g���壬��þ���Al2O3����������Ϊ ����ȷ��0.001����
����Һ��ͨ��CO2�������ķ�ӦΪ:2NaAl(OH)4 + CO2��2Al(OH)3��+ Na2CO3+ H2O
������0.5 mol Na2CO3��������Al(OH)3 mol��
52.2.�з�ӦAl2O3(s)+ Na2CO3(s) 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O��2Al(OH)3��+ Na2CO3
������������R��Na2CO3Ϊԭ�ϣ����õ�Al2O3�⣬���õ������ࡱ����ɷ�Ϊ������Ԫ�ؾ�����������ʽ��ʾ����
Al2O3 | Fe2O3 | Na2O | |
�������� | 0.065 | 0.850 | 0.029 |
ÿ1t������������ʱ��
�õ��ij��� t����ȷ��0.001����ͬ����
���Ƶ�Al2O3�� t��
��Ҫ���乺��Na2CO3 kg��
53.3.ȡa g Al2O3�������ʵ���������Ϊb��������Һ�У���ַ�Ӧ��������Һ����һ������(NH4)2SO4�����ȡ����裬��ȴ��ȫ����Һ����ת��Ϊ45.3 g��立�����[NH4Al(SO4)2��12H2O��ʽ����453]����a= ��b= ����ȷ��0.001��.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ��о�����������ѧ����ĩ��ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ܷ�ӦΪ Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)+Q kJ �����ܷ��������¹��̣�
2Fe(s)+3CO2(g)+Q kJ �����ܷ��������¹��̣�
��3Fe2O3(s)+CO(g) �� 2Fe3O4(s)+CO2(g)+Q1 kJ��
��Fe3O4(s)+CO(g) �� 3FeO(s)+CO2(g)+Q2 kJ��
��FeO(s)+CO(g) �� Fe(s)+CO2(g)+Q3 kJ��
��Q��Q1��Q2��Q2�Ĺ�ϵʽ��ȷ����
A��Q=Q1+Q2+Q3 B��Q=Q1-Q2-Q3
C��Q=(Q1+2Q2+6Q3)/3 D��Q=(Q1+2Q2+6Q3)/2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���Ϻ��о�����������ѧ����ĩ��ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
C-12ԭ�ӵ�������1.992��10-23g,���ӵ�������1.674��10-24 g�������ӵ��������Ϊ
A��1 B��1.000 C��1.007 D��1.008
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
1.52 gͭþ�Ͻ���ȫ�ܽ���50 mL�ܶ�Ϊ1.40 g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4 �Ļ������1120 mL (��״��)����Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54 g����������˵������ȷ����
A���úϽ���ͭ��þ�����ʵ���֮����2��1
B����Ũ������HNO3�����ʵ���Ũ����14.0 mol/L
C��NO2��N2O4 �Ļ�������У�NO2 �����������80%
D���õ�2.54 g����ʱ������NaOH��Һ�������600 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ƶϺ�������
A���ڳ����£�Na2SiO3+H2O+CO2=Na2CO3+H2SiO3����˵��H2CO3����ǿ��H2SiO3���ڸ����£�Na2CO3+SiO2= Na2SiO3+CO2����˵��H2SiO3����ǿ��H2CO3��
B������������������ɢϵ�ı����ص����ܲ������������
C��KAl(SO4)2��12H2O�Ǹ��Σ�(NH4)2Fe(SO4)2Ҳ�Ǹ���
D��CaCl2��NaOH��HCl��HD�������ʶ����ڻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ����12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ճ������е�������������ԭ��Ӧ�ص���
A��ͭ�������ϳ���ͭ��[Cu2(0H)2C03]
B����ʯ��㶹��
C�������̷������Ѭ������������ѿ��
D������ˮ����������ˮ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ��������ε��п��Ի�ѧ�Ծ��������棩 ���ͣ������
[��ѧ�����л���ѧ����](15��)����̪(J)�������ᡢ�жȼ�����ȱѪ��ҩ��ϳ�J��һ��·������

��E�ĺ˴Ź�������ֻ��һ��壻
��C�ܷ���������Ӧ��
��J��һ�����������г����������һ����Ԫ����
�ش��������⣺
��1����A����B�Ļ�ѧ����ʽΪ ���䷴Ӧ����Ϊ
��2��D�Ļ�ѧ������
��3��J�Ľṹ��ʽΪ ����D����E�Ļ�ѧ����ʽΪ
��4��G��ͬ���칹���к˴Ź���������4��������� ��Һ������ɫ��Ӧ�Ľṹ��ʽΪ (д��һ�ּ���)
��Һ������ɫ��Ӧ�Ľṹ��ʽΪ (д��һ�ּ���)
��5���ɼ�ȩ�ͻ�����A�����в���ɵõ�2һ�����Ҵ���

��Ӧ����1Ϊ ����Ӧ����2��ѡ����Լ�Ϊ ��L�Ľṹ��ʽΪ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com