
炼铁的总反应为 Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)+Q kJ ,可能发生了以下过程:
2Fe(s)+3CO2(g)+Q kJ ,可能发生了以下过程:
①3Fe2O3(s)+CO(g) → 2Fe3O4(s)+CO2(g)+Q1 kJ;
②Fe3O4(s)+CO(g) → 3FeO(s)+CO2(g)+Q2 kJ;
③FeO(s)+CO(g) → Fe(s)+CO2(g)+Q3 kJ。
则Q与Q1、Q2、Q2的关系式正确的是
A.Q=Q1+Q2+Q3 B.Q=Q1-Q2-Q3
C.Q=(Q1+2Q2+6Q3)/3 D.Q=(Q1+2Q2+6Q3)/2
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
用NaOH固体配制一定物质的量浓度的溶液200 mL,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法错误的是
A.若8>m>3,则X必定为主族元素
B.若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X
C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子
D.若a=b=3,8>m>n>b,则元素非金属性:X>Y
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
磷是重要的非金属元素。
28.1.有关的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.2.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.3.25℃时,HF的Ki = 3.6×10 – 4 ;H3PO4的 Ki1= 7.5×10 -3,Ki2= 6.2×10 -8,Ki3= 2.2×10 -13。
则以下表述错误的是 (选填编号)。
a.0.1mol/L的H3PO4溶液,c(H+)>0.1mol/L
b.NaF和H3PO4反应生成NaH2PO4
c.0.1mol/L的溶液,pH由大到小的顺序是:Na3PO4>Na2HPO4>NaF>NaH2PO4
31.4.Ag3PO4是难溶于水的黄色固体,试用平衡移动的原理解释其溶于稀硝酸的原因 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。20.2g该样品与100 mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A.78 B.140 C.156 D.172
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
硝基苯中溶有少量CaCl2,适宜的提纯方法是
A.过滤 B.蒸馏 C.分液 D.纸上层析
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:

以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)
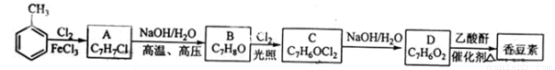
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)A的化学名称为__________;
(2)香豆素的分子式为_______;由甲苯生成A的反应类型为___________;
(3)B的同分异构体中含有苯环的还有_____种,其中在核磁共振氢谱中只出现四组峰的有_____种;
(4)由B生成C的化学反应方程式为___________;
(5)D的同分异构体中含有苯环的还有______种,其中:既能发生银境反应,又能发生水解反应的是________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各1.5mol,Mg2+为0.5mol,则SO42-的物质的量是
A.0.25 mol B.0.5mol C.0.75mol D.0.75mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质](15分)
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,

化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com