
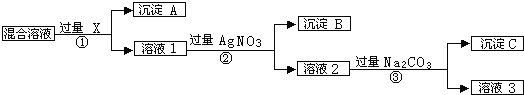
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应过程用如图表示:
(1)写出下列物质的化学式X__________;
(2)写出步骤③涉及到的离子反应__________,__________;
(3)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的__________(填化学式),之后若要获得固体NaNO3需进行的实验操作是__________(填操作名称).
【答案】Ba(NO3)2 Ba2++CO32﹣═BaCO3↓ 2Ag++CO32﹣═Ag2CO3↓ HNO3 蒸发结晶
【解析】
除去溶液中的氯化钠和硫酸钠,根据实验过程分析,先除去硫酸钠,应引入钡离子,不引入新杂质,可以用硝酸钡,因为还要加入硝酸银,所以可以用氯化钡,沉淀A为硫酸钡。溶液1中含有硝酸钠和氯化钡和氯化钠,加入过量的硝酸银生成氯化银沉淀,溶液2中含有硝酸钠和硝酸钡和硝酸银,加入过量的碳酸钠,得到碳酸银沉淀,溶液3为碳酸钠和硝酸钠,沉淀3为碳酸银。
(1)物质的除杂过程需加入稍过量的除杂试剂,且不能引入新杂质,所以加入过量的Ba(NO3)2;
(2)步骤③加入过量的碳酸钠,除去溶液中的Ag+和Ba2+,发生反应的离子方程式为:Ba2++CO32﹣═BaCO3↓;2Ag++CO32﹣═Ag2CO3↓;
(3)按此实验方案,因为加入的Na2CO3过量,所以得到的溶液3中肯定含有Na2CO3杂质;为了除去该杂质,可以向溶液3中加入过量的HNO3,之后若要获得纯NaNO3固体,还需进行的实验操作是蒸发结晶。


科目:高中化学 来源: 题型:
【题目】如表所示是A、B、C、D、E四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为88的E |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式:_______________。
(2)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
(3)B在加热时,能与混酸(浓硫酸和浓硝酸的混合溶液)反应,其化学方程式为___________。
(4)D的结构简式是____________。
(5)如图所示,该实验装置可用于C和D反应制取E。
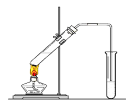
试回答下列问题:
①在右试管中通常加入__________溶液,其作用为___________;
②实验生成E的反应方程式为____________,分离右试管中所得E的操作为__________(填操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列 离子组在对应的溶液中一定能大量共存的是
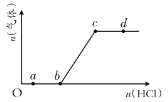
A.a点对应的溶液中:Fe3+、AlO2-、SO42-、NO3-
B.b 点对应的溶液中:K+、Ca2+、I-、Cl-
C.c 点对应的溶液中:Na+、Ca2+、NO3-、Ag+
D.d 点对应的溶液中:F-、NO3-、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验装置或操作的说法中,正确的是( )
A.图①实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2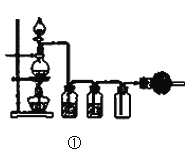
B.图②实验中若左边棉球变为橙色,右边棉球变为蓝色,则能证明非金属性:Cl>Br>I
C.图③实验中试管内的溶液中会生成血红色沉淀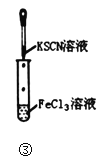
D.图④操作中可用酒精提取溴水中的溴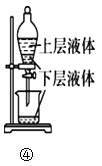
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若充入与反应无关的气体,由于保持压强不变,则反应速率不变
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL1mol/L的NaOH溶液恰好完全反应
D.反应至4min时,若HCl浓度为0.12mol/L,则0~4min内H2的反应速率为0.03moL/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
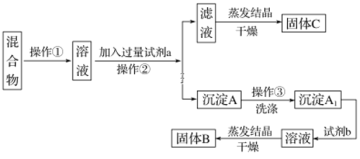
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是______,操作②的名称是_________。
(2)试剂a是________(填化学式,下同),试剂b是_______,固体B是________。
(3)加入试剂a所发生反应的化学方程式为_______。加入试剂b所发生反应的离子方程式为______。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)___。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com