
【题目】关于下列实验装置或操作的说法中,正确的是( )
A.图①实验室用MnO2固体与浓盐酸共热,制取并收集干燥、纯净的Cl2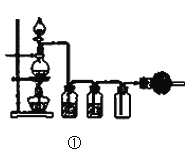
B.图②实验中若左边棉球变为橙色,右边棉球变为蓝色,则能证明非金属性:Cl>Br>I
C.图③实验中试管内的溶液中会生成血红色沉淀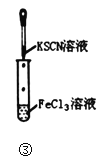
D.图④操作中可用酒精提取溴水中的溴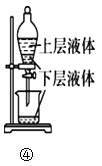
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油的催化重整可以得到芳香烃,说明石油中含有芳香烃
B. 煤的干馏和石油裂解得到的产物相同
C. 石油分馏得到的产物可用来萃取溴水中的溴
D. 聚丙烯塑料的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】模拟电渗析法将海水淡化的工作原理示意图如下。己知X、Y均为惰性电极,模拟海水中富含Na+、Cl—、Ca2+、Mg2+、SO42—等离子。下列叙述中不正确的是

A.N是阴离子交换膜
B.Y电极上产生有色气体
C.X电极区域有浑浊产生
D.X电极反应式为4OH——4e—=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应过程用如图表示:
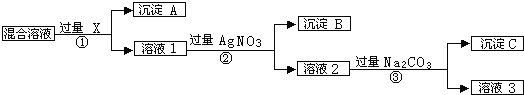
(1)写出下列物质的化学式X__________;
(2)写出步骤③涉及到的离子反应__________,__________;
(3)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的__________(填化学式),之后若要获得固体NaNO3需进行的实验操作是__________(填操作名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与Cl2生成CH3Cl的反应过程中,中间态物质的能量关系如下图所示(Ea表示活化能),下列说法不正确的是

A. 已知Cl·是由Cl2在光照条件下化学键断裂生成的,该过程可表示为:![]()
B. 相同条件下,Ea越大反应速率越慢
C. 图中ΔH<0,其大小与Ea1、Ea2无关
D. CH4转化为CH3Cl的过程中,所有C-H发生了断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
Ⅰ.已知反应:①CH4(g)+H2O (g) ![]() CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②C(s)+H2O (g) ![]() CO(g)+ H2(g) ΔH=+131 kJ·mol-1
CO(g)+ H2(g) ΔH=+131 kJ·mol-1
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。CH4(g) ![]() C(s)+2H2(g) ΔH=________kJ·mol-1。
C(s)+2H2(g) ΔH=________kJ·mol-1。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是_______(填序号)
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
Ⅱ.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:
(1)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
A.v(H2)正=v(CH3OH)逆 B.2v(CO)=v(H2)
C.CO与H2转化率相等 D.CO与H2的物质的量之比不再改变
(2)图是该反应在不同温度下CO的转化率随时间变化的曲线。温度T1和T2大小关系是T1____T2(填“>”、“<”或“=”),对应温度的平衡常数大小关系是K1____K2(填“>”、“<”或“=”)。
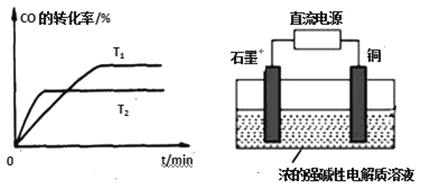
(3)用甲醇燃料电池作为直流电源,设计如图2装置制取Cu2O,写出铜电极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)![]() 2HI(g) ΔH1=-9.48 kJ·mol-1
2HI(g) ΔH1=-9.48 kJ·mol-1
②H2(g)+I2(?)![]() 2HI(g) ΔH2=+26.48 kJ·mol-1
2HI(g) ΔH2=+26.48 kJ·mol-1
下列判断不正确的是( )
A.①中的I2为气态,②中的I2为固态
B.②的反应物总能量比①的反应物总能量低
C.反应①的产物比反应②的产物热稳定性更好
D.1 mol固态碘升华时将吸热35.96 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
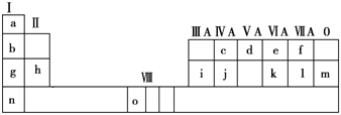
试回答下列问题:
(1)请写出元素o的基态原子电子排布式__________________________________。
(2)d的氢化物的分子构型为____________,中心原子的杂化形式为________;k在空气中燃烧产物的分子构型为________,中心原子的杂化形式为________,该分子是________(填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序排列如图,其中序号“8”代表________(填元素符号);其中电负性最大的是________(填图中的序号)。
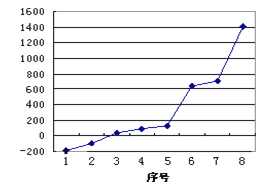
(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是________,试从结构角度加以解释______________。
(5)i单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
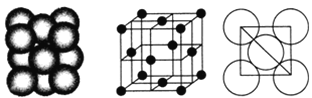
甲 乙 丙
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
②该晶体的密度为________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
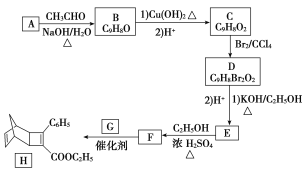
已知:①RCHO+CH3CHO![]() RCH===CHCHO+H2O;②||+
RCH===CHCHO+H2O;②||+![]()
![]() 。
。
回答下列问题:
(1)A的化学名称是________。
(2)由C生成D和E生成F的反应类型分别是________、________。
(3)E的结构简式为_________________________________。
(4)由B 生成C加入氢氧化铜,加热反应的化学方程式为________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com