
【题目】某同学用0.2000mol/L的NaOH溶液滴定25.00mL某未知浓度的盐酸(指示剂为酚酞),滴定结果如下:
第一次 | 第二次 | |
NaOH起始读数 | 0.10mL | 0.30mL |
NaOH终点读数 | 18.60mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为__________mol/L。
(2)达到滴定终点的标志是___________。
(3)该同学的实验操作如下:
A.用酸式滴定管移取25.00mL的稀盐酸于锥形瓶中,滴加几滴酚酞试液;
B.用待测的稀盐酸润洗酸式滴定管;
C.检查滴定管是否漏水;
D.用蒸馏水洗干净滴定管;
E.另取锥形瓶,重复操作一次;
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管至“0”刻度以上2cm,再把碱式滴定管固定好,调节液面至“0”刻度以下;
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶至滴定终点,记下滴定管液面所在刻度。
滴定操作的正确顺序是(用序号表示):C;_____;_____;A;C;D;F;G;E。
(4)实验操作G中在锥形瓶下垫一张白纸的作用_____________________。
【答案】0.1448 无色变粉红色且30s不变色 D B 便于观察滴定终点时锥形瓶内溶液颜色的变化
【解析】
(1)计算两次实验消耗NaOH溶液的平均体积,然后根据HCl~NaOH求盐酸的物质的量浓度;
(2)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色;
(3)根据酸碱中和滴定操作判断顺序;
(4)根据操作对c(待测)=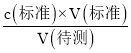 的影响进行分析滴定误差。
的影响进行分析滴定误差。
(1)二次消耗的NaOH溶液的体积分别为:18.50mL,17.70mL,两次消耗盐酸溶液的平均体积为18.10mL,根据酸碱中和反应HCl+NaOH=NaCl+H2O可知 HCl~NaOH,n(HCl)=n(NaOH),则c(HCl) ×25.00mL=0.20mol/L×18.10mL,解得:c(HCl) =0.1448mol/L;
(2)NaOH溶液滴定盐酸,以酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色且30s不变色,说明反应达到滴定终点;
(3)进行酸、碱中和滴定,首先应该检查滴定管是否漏水,然后用蒸馏水洗干净滴定管,用待测的稀盐酸润洗酸式滴定管;再用酸式滴定管移取25.00mL的稀盐酸于锥形瓶中,滴加几滴酚酞试液;检查滴定管是否漏水,然后用蒸馏水洗干净滴定管,取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管至“0”刻度以上2cm,再把碱式滴定管固定好,调节液面至“0”刻度以下;最后把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶至滴定终点,记下滴定管液面所在刻度。为减小实验误差,再另取锥形瓶,重复操作一次,故合理操作顺序为C、D、B、A、C、D、F、G、E。
(4)根据c(待测)=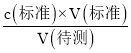 进行误差分析,实验操作G中在锥形瓶下垫一张白纸的作用就是便于观察滴定终点时锥形瓶内溶液颜色的变化,减小因滴定终点判断失误引起的误差,使实验测定值更接近真实值。
进行误差分析,实验操作G中在锥形瓶下垫一张白纸的作用就是便于观察滴定终点时锥形瓶内溶液颜色的变化,减小因滴定终点判断失误引起的误差,使实验测定值更接近真实值。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质
B.苯和浓硝酸在55~60℃,浓硫酸存在时发生硝化反应
C.甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应
D.等质量的烃(CxHy)耗氧量取决于![]() 的值,越大则耗氧多
的值,越大则耗氧多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是

A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中,有广泛应用,它的工作原理如下:Cd+2NiO(OH)+2H2O ![]() Cd(OH)2+2Ni(OH)2.下列叙述正确的是
Cd(OH)2+2Ni(OH)2.下列叙述正确的是
A. 该电池放电的时候,负极附近pH增大
B. 放电时每转移2mol电子,有2mol NiO(OH)被氧化
C. 充电时,阳极反应式是Ni(OH)2-e-+OH-=NiO(OH)+H2O
D. 充电时,Cd电极接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molFeCl3完全水解生成的Fe(OH)3胶粒数为0.1NA
B.0.1mol/LNa2SO3溶液中离子总数大于0.3NA
C.电解精炼铜时,阴极增重3.2g,电路中转移电子数为0.1NA
D.将0.1molO2与0.2molNO在密闭容器中允分反应,反应后容器内分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是( )
A.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种
B.结构简式为![]() 的烃,分子中含有两个苯环的该烃的同分异构体为2种
的烃,分子中含有两个苯环的该烃的同分异构体为2种
C.含有5个碳原子的饱和链烃,其一氯取代物有8种
D.菲的结构简式为 ,它与硝酸反应,可生成3种一硝基取代物
,它与硝酸反应,可生成3种一硝基取代物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com