
【题目】二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。

(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:

上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为_______________.
【答案】a -196.6 4 < 取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸上,待变色后立即对照标准比色卡读数 2c(SO32-)+c(HSO3-) 减小 Na2SO3+Ca(OH)2![]() CaSO3↓+2NaOH
CaSO3↓+2NaOH
【解析】
(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率;
(2)测得SO2的平衡转化率为50%,可知反应的SO2物质的量为1mol,此过程中放出热量98.3kJ,可知2molSO2参加反应放出的热量,以此计算a值;计算出平衡时各物质的浓度,可计算平衡常数;若将初始温度为T1℃的2mol SO2和1molO2充入容积为2L的绝热密闭容器B中,因正反应放热,则体系温度升高,升高温度平衡逆向移动;
(3)测定pH,可用玻璃棒蘸取溶液,然后与比色卡对比;向A中加入适量的NaOH固体,使溶液恰好呈中性,根据电荷守恒判断离子关系;将溶液B久置于空气中,亚硫酸被氧化生成硫酸,溶液酸性增强;
(4)可循环利用的为NaOH,可用亚硫酸钠与氢氧化钙反应生成。
(1)用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,由于反应不需要加热,排除装置c;由于亚硫酸钠是细小颗粒,易溶于水,不可选用装置bd,故可选用的发生装置是a;
(2)测得SO2的平衡转化率为50%,可知反应的SO2物质的量为1mol,此过程中放出热量98.3kJ,可知2molSO2参加反应放出的热量为196.6,则a=-196.6;
平衡时:c(SO2)=0.5mol/L,c(O2)=0.5mol/L,c(SO3)=0.25mol/L,K=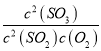 =4;因正反应放热,在绝热密闭容器中进行,体系温度升高,平衡逆向移动,则平衡常数减小;
=4;因正反应放热,在绝热密闭容器中进行,体系温度升高,平衡逆向移动,则平衡常数减小;
(3)测定pH,可用玻璃棒蘸取溶液,然后与比色卡对比,操作方法为取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸上,待变色后立即对照标准比色卡读数;向A中加入适量的NaOH固体,使溶液恰好呈中性,溶液中存在c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),则c(Na+)=2c(SO32-)+c(HSO3-);将溶液B久置于空气中,亚硫酸被氧化生成硫酸,溶液酸性增强,则水的电离程度减小;
(4)可循环利用的为NaOH,可用亚硫酸钠与氢氧化钙反应生成,反应的方程式为Na2SO3+Ca(OH)2=CaSO3↓+2NaOH。


科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+ 。将一定量的该磁黄铁矿与l00 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0. 425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法不正确的是
A.该盐酸的物质的量浓度为8.5 mol/L
B.生成的H2S气体在标准状况下的体积为9.52 L
C.该磁黄铁矿FexS中,x=0. 85
D.该磁黄铁矿FexS中,Fe2+的物质的量为0. 15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显色_________。
(2)能说明第①步反应达平衡状态的是___________。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO47H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要c(Cr3+)降至105mol/L,溶液的pH应调至_________________。
Cr3+(aq)+3OH(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要c(Cr3+)降至105mol/L,溶液的pH应调至_________________。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为____________。
(6)在阴极附近溶液pH升高的原因是__________(用电极反应解释),溶液中同时生成的沉淀还有_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,
①该反应在低温下___________(填“能”或“不能”)自发进行。
②写出该反应的平衡常数表达式_________________。
(2)已知在400℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正________v(N2)逆(填“>”、“<”、“=”或“不能确定”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________移动(填“向左”、“向左”或“不”);反应的ΔH__________(填“增大”、“减小”或“不改变”)。
(3)水煤气转化反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
① 实验l中以CO2表示的反应速率为v(CO2)=____________;
② 实验1的平衡常数K1__________实验2的平衡常数K2(填“大于””小于,“等于”“不能确定”)。
③ 该反应正方向为_____________(填“吸”或‘放”)热反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为1L的密闭容器中![]() 体积不变
体积不变![]() 充入
充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。下列说法正确的是
的浓度随时间变化如图所示。下列说法正确的是
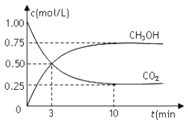
A.从反应开始到平衡,氢气的平均反应速率为![]()
B.进行到3min时,正反应速率和逆反应速率相等
C.10min后容器中各物质的量浓度不再改变
D.到达平衡状态时,反应放出![]() 的能量
的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2N2O5(g )=2N2O4( g )+O2( g ) H1=-4.4kJ·mol-1
2NO2( g)=N2O4(g ) H2 =-55.3kJ·mol-1
则反应N2O5( g )=2NO2(g )+![]() O2(g )的H=_______ kJ·mol-1
O2(g )的H=_______ kJ·mol-1
(2)2molCH3OH(l)在O2(g)中完全燃烧,生成CO2(g)和H2O(l),放出887kJ热量:请写出CH3OH燃烧热的热化学方程式__________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com