
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取150mLO2所需的时间(秒)
| 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①该研究小组在设计方案时。考虑了浓度、___________、____________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________________。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%(密度为1.0g/cm3)的双氧水中,并用带火星的木条测试。测定结果如下:
实验 序号 | 催化剂(MnO2) | 操作 情况 | 观察结果 | 反应完成 所需的时间 |
A | 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 5span>分钟 |
B | 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
① 写出H2O2发生分解的化学反应方程式________________。求出实验A中H2O2在5分钟内的平均反应速率________________。(结果保留小数点后两位数字)
② 实验结果说明催化剂作用的大小与____________________有关。
【答案】温度 催化剂 其他条件不变时,增大H2O2浓度,H2O2分解速率增大,减小H2O2浓度,H2O2分解速率减小 2H2O2![]() 2H2O+O2↑ 0.29mol/(L·min) 催化剂的接触面积
2H2O+O2↑ 0.29mol/(L·min) 催化剂的接触面积
【解析】
(1) H2O2在常温下很难分解得到氧气,其分解速度受浓度、温度、催化剂等因素的影响。设计实验方案来证明时,要注意实验的控制变量,以确保实验结果的准确性;
(2) MnO2是H2O2分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式;根据v=![]() 计算用H2O2表示的反应速率大小,由实验现象可知,催化剂表面大小的影响因素。
计算用H2O2表示的反应速率大小,由实验现象可知,催化剂表面大小的影响因素。
(1)①根据表中给出的数据,无催化剂不加热的情况下,不同浓度的H2O2溶液都是几乎不反应,在无催化剂加热的情况下,不同浓度的H2O2溶液都分解,说明H2O2的分解速率与温度有关,但是得到相同气体的时间不同,浓度越大,反应的速度越快,说明H2O2的分解速率与浓度有关;比较同一浓度的H2O2溶液如30%时,在无催化剂加热的时候,需要时间是360s,有催化剂加热的条件下,需要时间是10s,说明H2O2的分解速率与温度、催化剂有关,故该研究小组在设计方案时。考虑了浓度、温度、催化剂等因素对过氧化氢分解速率的影响;
②分析表中数据可以看出,浓度越大,反应速率越快;加热能加快H2O2的分解,使用合适的催化剂能使H2O2分解速率快;
(2)①H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O2![]() 2H2O+O2↑;c(H2O2)=
2H2O+O2↑;c(H2O2)=![]() mol/L=1.47mol/L,在5min内完全反应,则用H2O2表示的反应速率v(H2O2)=
mol/L=1.47mol/L,在5min内完全反应,则用H2O2表示的反应速率v(H2O2)=![]() = 0.29mol/(L·min);
= 0.29mol/(L·min);
②因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明催化剂的接触面积对反应速率有影响。


科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种高效复合肥。工业上以磷精矿[主要成分是Ca3(PO4)2,还含有少量Fe2O3、CaF2等杂质]为原料,生产磷酸二氢钾的流程如图:

已知:①TBP、D2EHPA、TOA都是难溶于水的液态有机物,对萃取特定物质有较强的选择性,常用作萃取剂。
②萃取剂TBP对H3PO4和Fe3+有较强的萃取作用,但对Ca2+有一定的萃取作用。
③萃取剂D2EHPA仅对Fe3+有较强的萃取作用。
回答下列问题:
(1)“制酸”过程中生成磷酸的化学方程式为______。
(2)“除氟”时发生反应的化学方程式为______。
(3)“目的1”是______。
(4)“目的2”分离出的有机层中除H3PO4外,还有少量某金属阳离子。去除有机层中该阳离子的方法是用含H2SO4的磷酸洗涤,反应的离子方程式为______。
(5)“反应”时先在磷酸中加入KCl,再加入TOA,TOA的作用是______。
(6)“反应”中,TOA的用量会影响溶液的pH。水溶液中H3PO4、H2PO4-、HPO42-、PO43-的分布分数δ(含磷元素微粒占全部含磷粒子的物质的量分数)随pH的变化如图所示。

“反应”中,当pH=______(填选“2.2”、“4.5”、“9.5”或“12.4”)时,停止加入TOA。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基自由基(·OH,电中性,O为-1价)是一种活性含氧微粒。常温下,利用·OH处理含苯酚废水,可将其转化为无毒的氧化物。
(1)·OH的电子式为________。
(2) pH=3时Fe2+催化H2O2的分解过程中产生·OH中间体,催化循环反应如下。将ii补充完整。
i.Fe2++ H2O2+H+ === Fe3++ H2O +·OH
ii.___ + ___ === ___ + O2↑+2H+
(3)已知:羟基自由基容易发生猝灭2·OH === H2O2。用H2O2分解产生的·OH脱除苯酚,当其他条件不变时,不同温度下,苯酚的浓度随时间的变化如下图所示。0~20 min时,温度从40℃上升到50℃,反应速率基本不变的原因是________。


(4)利用电化学高级氧化技术可以在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如上图所示。已知a极主要发生的反应是O2生成H2O2,然后在电解液中产生·OH并迅速与苯酚反应。
① b极连接电源的________极(填“正”或“负”)。
②a极的电极反应式为________。
③电解液中发生的主要反应方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据下图中的能量关系,可求得C-H的键能为______________。

(2)X(s)+3Y(g)![]() Z(g)+3W(g) ΔH=-akJ/mol,一定条件下,将2molX和2molY通入2L的恒容密闭容器中,反应10s后达到平衡,测得生成0.5molZ。
Z(g)+3W(g) ΔH=-akJ/mol,一定条件下,将2molX和2molY通入2L的恒容密闭容器中,反应10s后达到平衡,测得生成0.5molZ。
①则10s内,Y的平均反应速率为_____________,第10s时,X的物质的量为__________,Y的浓度为_______,10s内,X和Y反应放出的热量Q为______。
②判断该反应是否达到平衡的依据是__________(填字母)。
A.压强不随时间改变 B.气体的密度不随时间改变
C.c(Y)不随时间改变 D.单位时间里生成Z和W的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解有关的是
①明矾可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③NH4Cl溶液可作焊接中的除锈剂
④实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞而不能用玻璃塞
A.①④B.②③C.③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
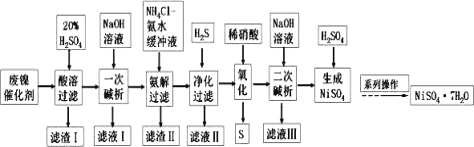
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。请回答下列问题:
(1)为提高“酸溶”时镍元素的浸出率,所采取的的措施为____(写1种)。
(2)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为_______。
(3)“氨解”的目的为__ “氨解”时需要控制低温原因是______。
(4)“氧化”时发生反应的化学方程式为_____。
(5)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于_____。(已知:Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(6)若在流程中完成“系列操作”。则下列实验操作中,不需要的是____(填下列各项中序号)。
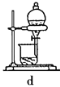
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在PbI2饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是( )
Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是( )
A.溶液中Pb2+和I-浓度都增大
B.溶度积常数Ksp增大
C.沉淀溶解平衡向逆向移动
D.PbI2的溶解度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com