
【题目】已知C—C键可以绕键轴自由旋转,结构简式为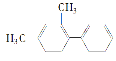 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )
A.分子中至少有10个碳原子处于同一平面上
B.分子中至少有8个碳原子处于同一平面上
C.分子中至多有14个碳原子处于同一平面上
D.该烃不属于苯的同系物
科目:高中化学 来源: 题型:
【题目】吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。
已知:室温下,ZnSO3微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-、SO32-的物质的量分数随pH的分布如图-1所示。

(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为___________;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是_____________(填化学式)。
(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40mim内,SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图-2)。溶液pH几乎不变阶段,主要产物是____________(填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为_______________。

(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5~6.5范围内,pH越低SO![]() 生成速率越大,其主要原因是__________;随着氧化的进行,溶液的pH将__________(填“增大”、“减小”或“不变”)。
生成速率越大,其主要原因是__________;随着氧化的进行,溶液的pH将__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成氧化铜,氧化铜再与硝酸反应。下列叙述正确的是( )
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量是:途径③>途径①>途径②
D.所消耗硝酸的物质的量是:途径①>途径②>途径③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A.向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+)
B.新制氯水使红色布条褪色(HCl)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-)
D.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物M和N(不考虑立体异构),其反应机理如图1所示;室温下,M可以缓慢转化为N,能量变化如图2所示。下列关于该过程的叙述错误的是
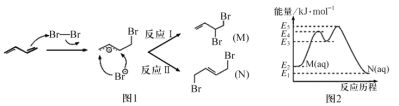
A.室温下,M的稳定性强于N
B.N存在顺反异构体
C.有机物M的核磁共振氢谱中有四组峰,峰面积之比为2:1:2:2
D. H=-(E2-E1)kJmol-1
H=-(E2-E1)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
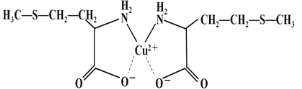
【题目】氨基酸微量元素螯合物在饲料生产应用、解决过量添加无机盐造成环境污染等方面有重要应用。该类螯合物通常以蛋氨酸、赖氨酸、甘氨酸等为配位体,以铜、铁、锌、锰、铬、钴等元素为中心离子。
(1)甘氨酸中共有_____个σ键,所含元素的电负性由大到小的顺序为______,官能团中C原子的杂化方式为_______。
(2)上述金属元素中,基态原子有五个未成对电子的原子的核外电子排布式为______。
(3)蛋氨酸铜的结构式如下图。该螯合物中含有的化学键类型有_________(填序号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。某化合物的化学式为Na3CrO8,其阴离子结构可表示为![]() ,则Cr的化合价为______。
,则Cr的化合价为______。![]() 呈四面体构型,结构为
呈四面体构型,结构为![]() ,
,![]() 由两个
由两个![]() 四面体组成,这两个
四面体组成,这两个![]() 四面体通过共用一个顶角氧原子彼此连接,结构为
四面体通过共用一个顶角氧原子彼此连接,结构为![]() 。则由n(n>1)个
。则由n(n>1)个![]() 通过顶角氧原子连结的链式结构的化学式为____。
通过顶角氧原子连结的链式结构的化学式为____。
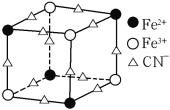
(5)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是____;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如下图所示(K+未画出),则一个晶胞中的K+个数为____。
结构如下图所示(K+未画出),则一个晶胞中的K+个数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
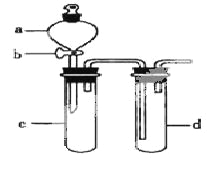
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________。
再由a向c中加2mL蒸馏水,c中的实验现象是_____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_______。
方案 | 反应物 |
甲 | Cu、浓硝酸 |
乙 | Cu、稀硝酸 |
丙 | Cu、O2、稀硝酸 |
(4)该小组同学向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸。观察到的实验现象是_________;该小组同学实验目的是_________,但此实验的不足之处是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公认的人体必需金属元素是钠和钾。在动物中,钠主要是以氯化钠形式存在于细胞外液中,依靠氯化钠可以把一定量的水吸到细胞里来,使细胞里维持一定的水分。某试剂瓶上贴有如下标签,对该试剂理解正确的是 ( )
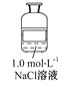
A.该溶液中含有的微粒主要有NaCl、Na+、Cl-、H2O
B.若取50毫升溶液,其中的c(Cl-)=0.05 mol·L-1
C.若取该溶液与100 mL 0.1 mol·L-1AgNO3溶液完全反应,需要取该溶液10 mL
D.该溶液与1.0 mol·L-1Na2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,向D溶液中加入KSCN溶液后,溶液显红色。在适宜的条件下可发生如下转化:
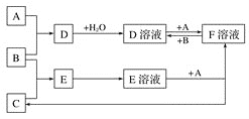
试回答下列问题:
(1)写出A、B、C的化学式:A_____、B_______、C_________。
(2)反应E溶液+A→F溶液+C的离子方程式为:______________ ; D溶液+A→F溶液的离子方程式为:___________;若向F溶液中加入NaOH溶液,观察到的现象为:_________。
(3)写出除去D溶液中F杂质的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com