
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A.向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+)
B.新制氯水使红色布条褪色(HCl)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-)
D.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2)
【答案】B
【解析】
A. 新制氯水中Cl2+H2O![]() H++Cl-+HClO,HClO
H++Cl-+HClO,HClO![]() H++ClO-且存在H2O
H++ClO-且存在H2O![]() H++ OH—,故在新制氯水中存在:H2O、Cl2、HClO、H+、Cl-、ClO-、OH—,向NaHCO3固体中加入新制的氯水,有无色气泡产生,是因为氯水中2H++ CO32—=H2O+CO2,故A项说法正确;B. 新制氯水使红色布条褪色,是由于HClO具有漂白性,与HCl无关,故B项说法错误;
H++ OH—,故在新制氯水中存在:H2O、Cl2、HClO、H+、Cl-、ClO-、OH—,向NaHCO3固体中加入新制的氯水,有无色气泡产生,是因为氯水中2H++ CO32—=H2O+CO2,故A项说法正确;B. 新制氯水使红色布条褪色,是由于HClO具有漂白性,与HCl无关,故B项说法错误;
C. 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生是由于Ag++Cl-=AgCl↓,故C项说法正确;
D. 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色,发生反应: 2Fe2++Cl2=2Cl-+2Fe3+,Fe3++3SCN—= Fe(SCN)3,故D项说法正确;
故选B。


科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
⑴氧化剂是_______________ , 还原剂是________________。
⑵氧化剂和还原剂的分子个数比___________________________。
⑶当有68克氨气参加反应时,被氧化的物质为_____________克, 生成还原产物为_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。
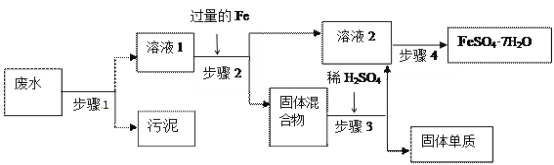
(1)步骤1的主要操作是__,需用到的玻璃仪器除烧杯外有______,_______。
(2)步骤2中发生反应的离子方程式为__________________________________。
(3)步骤3中发生反应的化学方程式为__________________________________。
(4)步骤4中涉及的操作是:蒸发浓缩._____________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G 的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30;E、F、G的最高价氧化物对应的水化物之间可以相互反应;G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图________________。
(2)A和D可形成化合物的化学式为______________。
(3)B元素在周期表中的位置为________________;过量的B元素的最高价氧化物与氢氧化钠溶液反应的离子方程式为__________________。
(4)D、E、F、G的离子半径由大到小顺序为(用离子符号表示)______________________。
(5)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为__________________。
(6)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为__________,能够用于漂白的固体物质中阴、阳离子个数比为____________。
(7)写出D元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);△H=a kJ/mol,下列叙述不正确的是( )

A. 反应过程中能量关系如上图表示,则该反应为放热反应
B. 若将该反应设计成原电池,锌为负极
C. 化学反应的焓变与反应方程式的计量数有关
D. 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
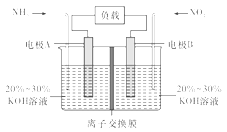
(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出阴极反应式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式为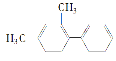 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )
A.分子中至少有10个碳原子处于同一平面上
B.分子中至少有8个碳原子处于同一平面上
C.分子中至多有14个碳原子处于同一平面上
D.该烃不属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C2H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)C3H6(g)+H2(g) H=____________kJ/mol
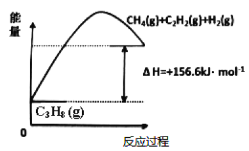
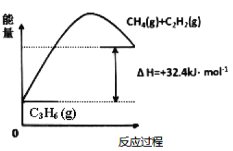
①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是________。
②目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:2C3H8(g) +O2(g)2C3H6(g)+2H2O(g) H=-235kJ/mol,通入O2的目的是_______。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8(g)+C2H4(g)2C3H6(g) H>0
①某温度下,上述反应中,正反应速率为v正=K正c(C4H8)c(C2H4)、逆反应速率为v逆=K逆c2(C3H6),其中K正、K逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是_____________
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使K正和K逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应程度无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___________25%(填“>”、“<”、“=”)。
(3)工业上可用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
Ⅰ. CH2=CHCH3(g)+Cl2(g)CH2ClCHClCH3(g)
II. CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应Ⅰ,容器内气体的压强随时间的变化如表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=____________kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸型酸雨的形成原理可简化表示如下:

回答下列问题:
(1)A物质的化学式_________,B物质的化学式_________。
(2)根据SO2的性质,可让工厂的烟道气通过________除去SO2,达到减少污染的目的。
(3)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:

注 溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是____________(用化学方程式表示)。
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将_________(填“增大”“减小”或“不变”),原因是(用化学方程式表示):_____________。
(4)你认为减少酸雨产生可采用的措施是_________(填序号)。
①少用煤做燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com