
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,回答问题:
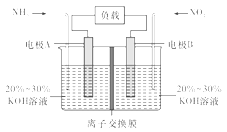
(1)电流从____(选填“左”或“右”,下同)侧电极经过负载后流向______侧电极。
(2)为使电池持续放电,离子交换膜需选用______离子交换膜(选填“阴”或“阳”)。
(3)A电极上的电极反应式为___________________________。
(4)当有4.48 L NO2(标准状况)被处理时,转移电子为________摩尔。
(5)负载可以测定电流大小,从而确定气体含量,酒驾测定工作原理与其相似。仔细阅读图:写出阴极反应式:____________________________。
【答案】右 左 阴 2NH3-6e-+6OH-=N2+6H2O 0.8 O2+4e-+4H+=2H2O
【解析】
由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极。
(1)A侧电极失去电子,电子流向为A电极→负载→B电极,故电流流向与电子流向相反为B电极→负载→A电极,故答案为:右;左。
(2)原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,故答案为:阴。
(3)电解质溶液呈碱性,则负极电极方程式为2NH3-6e-+6OH-=N2+6H2O。
(4)当有4.48L NO2(标准状况)即0.2mol被处理时,转移电子为0.2mol×(4-0)=0.8mol。
(5)负载与电池相连,则负载为电解池,电池总反应为CH3CH2OH+O2→CH3COOH+H2O,阴极反应式为O2+4e-+4H+=2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】明胶是水溶性蛋白质混合物、溶于水会形成胶体。工业明胶制成的胶囊中往往含有超标的重金属Cr,因而对人体造成伤害。
(1)用一束光照射明胶水溶液,可观察到______现象。
(2)Na2CrO4是工业上常用的氧化剂,工业上可用FeCr2O4(Cr元素的化台价为+3)制Na2CrO4,其反应为FeCr2O4+8Na2CO3+Na2CrO4+7O2 ![]() Na2CrO4+Fe2O3+8CO2↑。
Na2CrO4+Fe2O3+8CO2↑。
①FeCr2O4铁元素的化合价为_______,用氧化物的形式表示FeCr2O4的化学式:________
②该反应的氧化产物是_______;每生成1molNa2CrO4时,转移电子_____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酸是无色液体,密度1.79g·cm-3,沸点约152℃。氯磺酸有强腐蚀性,遇湿空气产生强烈的白雾,故属于危险品。制取氯磺酸的典型反应是在常温下进行的,反应为 HCl(g)+SO3 = HSO3Cl。实验室里制取氯磺酸可用下列仪器装置(图中夹持、固定仪器等已略去),实验所用的试剂、药品有:①密度1.19g·cm-3浓盐酸 ②密度1.84g·cm-3、质量分数为98.3%的浓硫酸 ③发烟硫酸(H2SO4··SO3) ④无水氯化钙 ⑤水。制备时要在常温下使干燥的氯化氢气体和三氧化硫反应,至不再吸收HCl时表示氯磺酸已大量制得,再在干燥HCl气氛中分离出氯磺酸。
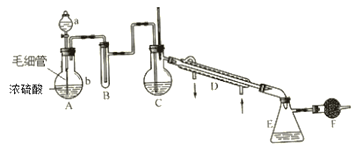
(1)仪器中应盛入的试剂与药品(填数字序号):A中的a____ B____ C_____ F_____ 。
(2)A的分液漏斗下边接有的毛细管是重要部件,在发生气体前要把它灌满a中液体,在发生气体时要不断地均匀放出液体。这是因为______________________________________。
(3)实验过程中需要加热的装置是___________________ (填装置字母)。
(4)若不加F装置,可能发生的现象是________________________________________, 有关反应的化学方程式______________________________________________________。
(5)在F之后还应加的装置是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | I3—溶液中存在平衡: I3— |
B | 在Ca(ClO)2溶液中通入SO2气体,有沉淀生成 | 酸性:H2SO3>HClO |
C | 向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去 | 氯气具有强氧化性和漂白性 |
D | 在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色 | 植物油含有酯基 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A.向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+)
B.新制氯水使红色布条褪色(HCl)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-)
D.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下(A~I)均为有机物):
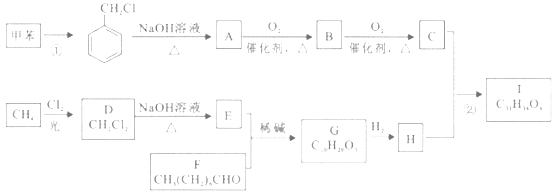
已知:a. 
b. 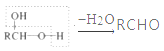
回答下列问题:
(1)反应①的化学方程式为_______;F的官能团名称为______。
(2)反应②的类型是_______
(3)G的结构简式为____________。
(4)芳香族化合物W的化学式为C8H8O2, 且满足下列条件的W的结构共有_______种(不考虑立体异构)。
i.遇FeCl3溶液显紫色; ii.能发生银镜反应。
其中核磁共振氢谱显示有5种不司化学环境的氢,峰面积比为2:2:2:1:1的是____________(写出结构简式)。
(5)设计以甲苯和乙醛为原料制备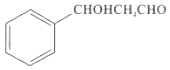 的合成路线。无机试剂任选,合成路线的表示方式为:
的合成路线。无机试剂任选,合成路线的表示方式为:![]() ____________
____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基酸微量元素螯合物在饲料生产应用、解决过量添加无机盐造成环境污染等方面有重要应用。该类螯合物通常以蛋氨酸、赖氨酸、甘氨酸等为配位体,以铜、铁、锌、锰、铬、钴等元素为中心离子。
(1)甘氨酸中共有_____个σ键,所含元素的电负性由大到小的顺序为______,官能团中C原子的杂化方式为_______。
(2)上述金属元素中,基态原子有五个未成对电子的原子的核外电子排布式为______。
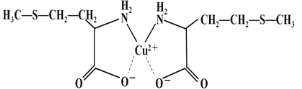
(3)蛋氨酸铜的结构式如下图。该螯合物中含有的化学键类型有_________(填序号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(4)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。某化合物的化学式为Na3CrO8,其阴离子结构可表示为![]() ,则Cr的化合价为______。
,则Cr的化合价为______。![]() 呈四面体构型,结构为
呈四面体构型,结构为![]() ,
,![]() 由两个
由两个![]() 四面体组成,这两个
四面体组成,这两个![]() 四面体通过共用一个顶角氧原子彼此连接,结构为
四面体通过共用一个顶角氧原子彼此连接,结构为![]() 。则由n(n>1)个
。则由n(n>1)个![]() 通过顶角氧原子连结的链式结构的化学式为____。
通过顶角氧原子连结的链式结构的化学式为____。
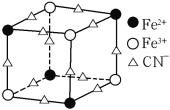
(5)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是____;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如下图所示(K+未画出),则一个晶胞中的K+个数为____。
结构如下图所示(K+未画出),则一个晶胞中的K+个数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中的曲线是表示其他条件一定时,2NO(g)+O2(g)2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )

A.a点
B.b点
C.c点
D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
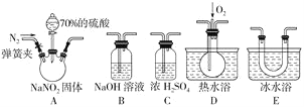
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com