
【题目】已知A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,向D溶液中加入KSCN溶液后,溶液显红色。在适宜的条件下可发生如下转化:
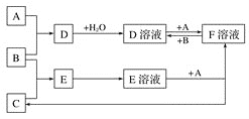
试回答下列问题:
(1)写出A、B、C的化学式:A_____、B_______、C_________。
(2)反应E溶液+A→F溶液+C的离子方程式为:______________ ; D溶液+A→F溶液的离子方程式为:___________;若向F溶液中加入NaOH溶液,观察到的现象为:_________。
(3)写出除去D溶液中F杂质的离子方程式:________。
【答案】Fe Cl2 H2 Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+ 溶液中生成白色沉淀,沉淀迅速变成灰绿色,最终变成红褐色 2Fe2++Cl2=2Fe3++2Cl-
【解析】
A、B、C为中学化学中常见的单质,在室温下A为固体,B和C为气体,A与B反应生成D,向D溶液中加入KSCN溶液后,溶液显红色,D溶液中含有Fe3+,由D于F相互转化可知,A为Fe,B为Cl2,D为FeCl3,F为FeCl2.B与C反应生成E,Fe与E溶液反应得到氯化亚铁与C,则C为H2,E为HCl,以此解答该题。
(1)向D溶液中加入KSCN溶液后,溶液显红色,故D溶液中含Fe3+,根据题干信息可推知A为Fe,结合框图中E溶液与A反应生成F溶液和气体C可确定E溶液为酸,故E为HCl,由此推知B、C分别为Cl2、H2,D、F分别为FeCl3、FeCl2。
(2)E为HCl,溶液与铁反应生成氯化亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑;氯化铁和铁反应生成氯化亚铁,反应的离子方程式为2Fe3++Fe=3Fe2+,F为FeCl2,加入氢氧化钠溶液,可生成不稳定的氢氧化亚铁,氢氧化亚铁不稳定,可被氧化生成氢氧化铁,现象为溶液中生成白色沉淀,迅速变灰绿色,最终变红褐色;
(3)除去氯化铁中的氯化亚铁,可通入氯气,发生氧化还原反应生成氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式为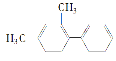 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )
A.分子中至少有10个碳原子处于同一平面上
B.分子中至少有8个碳原子处于同一平面上
C.分子中至多有14个碳原子处于同一平面上
D.该烃不属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在催化剂作用下将X和Y合成具有生物活性的物质Z,W是中间产物(R1、R2均为烃基)。

则下列有关叙述正确的是( )
A.反应①属于加成反应B.1 mol W最多可与3 mol NaOH反应
C.X、Y、W、Z都能与NaOH溶液反应D.可用溴水或FeCl3溶液鉴别出X和W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸型酸雨的形成原理可简化表示如下:

回答下列问题:
(1)A物质的化学式_________,B物质的化学式_________。
(2)根据SO2的性质,可让工厂的烟道气通过________除去SO2,达到减少污染的目的。
(3)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:

注 溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是____________(用化学方程式表示)。
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将_________(填“增大”“减小”或“不变”),原因是(用化学方程式表示):_____________。
(4)你认为减少酸雨产生可采用的措施是_________(填序号)。
①少用煤做燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
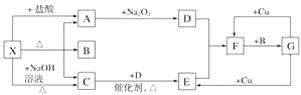
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯乙烯、异丙烯等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)![]() C3H6(g)+H2(g) ΔH=___kJ/mol。
C3H6(g)+H2(g) ΔH=___kJ/mol。

①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___。
②目前在丙烷脱氢制丙烯时常加入适量的O2,让其同时发生下列反应:
2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8+C2H4![]() 2C3H6(g) ΔH>0。
2C3H6(g) ΔH>0。
①某温度下,上述反应中,正反应速率为v正=k正c(C4H8)c(C2H4)、逆反应速率为v逆=k逆c2(C3H6),其中k正、k逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是___。
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使k正和k逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应历程无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___25%。(填“>”、“<”、“=”)
(3)工业上可用丙烯加成法制备1,2—二氯丙烷(CH2ClCHClCH3),主要副产物为3—氯乙烯(CH2=CHCH2Cl),反应原理为
Ⅰ.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g)
CH2ClCHClCH3(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
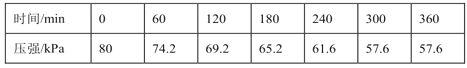
①用单位时间内气体分压的变化来表示反应速率,即v=![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__kPa-1。(Kp为以分压表示的平衡常数,保留小数点后2位。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国对二氧化硫一空气质子交换膜燃料电池的研究处于世界前沿水平,该电池可实现硫酸生产、发电和环境保护三位一体的结合。其原理如图所示。下列说法不正确的( )
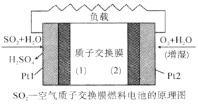
A.Pt1电极附近发生的反应为:SO2 + 2H2O-2e- = SO42-+4H+
B.相同条件下,放电过程中消耗的SO2和O2的体积比为2∶1
C.该电池工作时质子从Pt2电极经过内电路流到Pt1电极
D.该电池实现了制硫酸、发电、环保三位一体的结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的反应判断下列说法中错误的是

A. CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B. 该反应的焓变大于零
C. 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D. 由该反应可推出凡是需要加热才发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对废弃物的再利用,不仅能够减少污染,还能有效的节约资源,实现“变废为宝”。为实现某合金废料的再利用,设计流程如下:
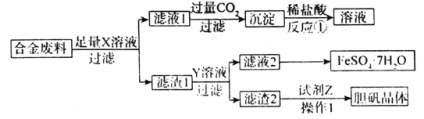
下列叙述错误的是
A.从合金废料回收的金属元素有Al、Fe、Cu
B.X可能是NaOH或H2SO4
C.操作1包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.滤渣1一定含有Fe和Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com