
【题目】右图中的曲线是表示其他条件一定时,2NO+O2![]() 2NO2 △H<0 ,反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 △H<0 ,反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是

A. a点 B. b点 C. c点 D. d点
【答案】D
【解析】试题分析:A、a点在曲线上,处于平衡状态,v(正)=v(逆),故A错误;B、b点在曲线上,处于平衡状态,v(正)=v(逆),故B错误;C、c点在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,即由c点向上引垂直线到曲线上的一点,这样NO的转化率要增大,平衡向右移动,故v(正)>v(逆),故C正确;D、d点在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,即由d点向下引垂直线到曲线上的一点,这样NO的转化率要减小,平衡向左移动,故v(正)<v(逆),故D错误;故选C。
【名师点晴】本题考查化学平衡图象,涉及平衡状态的判断、平衡移动等。判断曲线上的任意一点都表示达到平衡状态是关键。在曲线上,当温度一定时,NO的转化率也一定,故曲线上任意一点都表示达到平衡状态,而曲线外的任意一点都表示未达平衡状态.在曲线下方的任意一点,要想达到同温度下的平衡状态,即向上引垂直线到曲线上的一点,这样NO的转化率要增大,平衡向右移动,在曲线上方的任意一点,要想达到同温度下的平衡状态,即向下引垂直线到曲线上的一点,这样NO的转化率要减小,平衡向左移动。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
已知①常压下反应的能量变化如图所示。
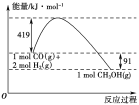
②
化学键 | H—H | H—O | O===O |
键能kJ/mol | 436 | x | 496 |
③CO(g)+1/2O2(g)===CO2(g)ΔH=-280 kJ/mol;
H2(g)+1/2O2(g)===H2O(l) ΔH=-284 kJ/mol
H2O(l)===H2O(g) ΔH=+44 kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_______________________。
(2)H—O键的键能x为________ kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为________ kJ/mol。
(4)在____(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如图所示。
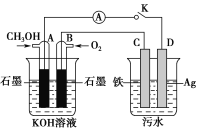
甲 乙
①写出甲池的A极电极反应式:__________________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的________。
A.H2SO4 B.BaSO4 C.Na2SO4 D.NaOH E.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南昌西汉海昏侯墓考古发现震惊全国,在打开内棺时,为了防止丝织品被氧化,需要充入一定的保护气体,这种气体是( )
A. H2 B. CO C. SO2 D. N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关蛋白质的说法正确的是( )
A.人工方法不能合成具有生命活力的蛋白质
B.蛋白质的变性是可逆过程
C.分离蛋白质和氯化钠的混合液可采用过滤的方法
D.用平行光照射蛋白质溶液,在垂直于光线的方向可看到一条光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨及铵盐的性质叙述中,正确的是
A. 氨气可用排水法收集
B. 氯化铵固体加热容易分解
C. 氨气和酸相遇都能产生白烟
D. 实验室用氢氧化钠溶液和氯化铵溶液加热制NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随PH的变化如图所示。下列叙述错误的是
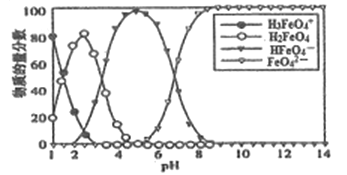
A. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4、K3=5.0×10-8.当pH=4时,溶渡中c(HFeO4-)/c(H2FeO4)=1.2
B. 向pH=5的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
C. PH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
D. 为获得尽可能纯净的高铁酸盐,应控制PH≥9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是 ( )
A.某特定反应的平衡常数仅是温度的函数
B.化学平衡发生移动,平衡常数必发生变化
C.其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
D.催化剂不能改变平衡常数的大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com