
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g), 反应过程中能量关系可用右图表示,下列叙述中不正确的是 ( )
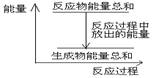
A.1 molZn的能量高于1 molH2的能量
B.反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量
C.如果Zn足量,反应速率会经历由慢到快到慢的过程
D.用锌粉代替锌粒,速率会加快
科目:高中化学 来源:2010—2011学年福建省三明一中、二中高一下学期联考化学试卷 题型:单选题
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g),下列叙述中不正确的是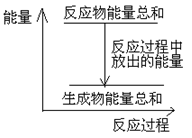
| A.Zn和H2SO4的总能量大于 ZnSO4和H2的总能量 |
| B.反应过程中能量关系可用上图表示 |
| C.若将该反应设计成原电池,则Zn为负极 |
| D.若将该反应设计成原电池,当有65g锌溶解时,正极放出11.2L气体 |
查看答案和解析>>
科目:高中化学 来源:2011-2012年安徽宿松县复兴中学高一下学期第三次月考化学试卷(解析版) 题型:选择题
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g), 反应过程中能量关系可用如图表示,下列叙述中不正确的是 ( )
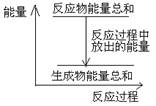
A. 1 molZn的能量高于1 molH2的能量
B. 用锌粉代替锌粒,速率会加快
C. 如果Zn足量,反应速率会经历由慢到快到慢的过程
D. 反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量
查看答案和解析>>
科目:高中化学 来源:2013届福建省、二中高一下学期联考化学试卷 题型:选择题
对于敞口容器中的反应:Zn(s)+H2SO4(aq)= ZnSO4 (aq)+H2(g),下列叙述中不正确的是
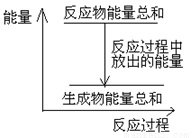
A.Zn和H2SO4的总能量大于 ZnSO4和H2的总能量
B.反应过程中能量关系可用上图表示
C.若将该反应设计成原电池,则Zn为负极
D.若将该反应设计成原电池,当有65g锌溶解时,正极放出11.2L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com