
【题目】2019年诺贝尔化学奖颁给在锂离子电池发展方面作出突出贡献的三位科学家,颁奖词中说:他们创造了一个可再充电的世界。下面是最近研发的Ca-LiFePO4可充电电池的工作示意图,锂离子导体膜只允许Li+通过,电池反应为:xCa2++2LiFePO4![]() xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是

A.LiPF6-LiAsF6为非水电解质,其与Li2SO4溶液的主要作用都是传递离子
B.放电时,负极反应为:LiFePO4xe===Li1-xFePO4+xLi+
C.充电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,放电时发生Li+嵌入
D.充电时,当转移0.2 mol电子时,左室中电解质的质量减轻2.6 g
【答案】B
【解析】
钙与水能够剧烈反应,所以,左室中的LiPF6LiAsF6电解质一定为非水电解质,Li2SO4溶液为右室中的电解质溶液,它们的主要作用都是传递离子,形成电流,构成闭合回路,A正确;放电时,负极反应为:Ca2e===Ca2+,使左室中正电荷数目增多,锂离子导体膜只允许Li+通过,使LiPF6LiAsF6电解质中的Li+通过锂离子导体膜移入右室,正极反应为:Li1xFePO4+xLi++xe===LiFePO4,电极发生Li+嵌入,B错误;充电时,阳极发生:LiFePO4xe===xLi++Li1xFePO4,电极发生Li+脱嵌,阴极发生:Ca2++2e===Ca,转移0.2 mol电子时,有0.2 mol Li+从右室通过锂离子导体膜移入左室,左室电解质中有0.1 mol Ca2+得电子生成Ca沉积在钙电极上,故左室中电解质的质量减轻40×0.1 g 7×0.2 g =2.6 g,C、D正确。


 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
【题目】某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )
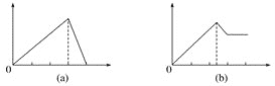
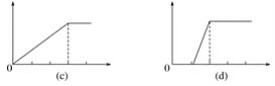
A.①-(d)B.②-(b)C.③-(c)D.④-(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B.电解饱和食盐水:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
C.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
D.向氨水中通入过量CO2:2NH3·H2O+CO2=2NH4++CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水时,下列叙述正确的是
A.正极产生氯气,负极产生氢气B.阳极得到的气体能使碘化钾溶液变蓝
C.在阳极区滴入酚酞试液,溶液显红色D.阳极得到氯气,阴极得到钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g) ![]() 2HI(g) △H=-9.48 k.J·mol-1
2HI(g) △H=-9.48 k.J·mol-1
②I2(s)+H2((g) ![]() 2HI(g)△H=+26.48k.J·mol-1
2HI(g)△H=+26.48k.J·mol-1
下列判断正确的是
A.254gI(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的生成物比反应②的生成物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10mol/LNa2S2O3溶液与0.10mol/L 稀H2SO4反应速率的影响。反应方程式为:Na2S2O3 +H2SO4=Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | A | 10.0 | y |
③ | 0 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为____________,乙是实验需要测量的物理量,则表格中“乙”为____________,x、y、z的大小关系是____________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g)+3H2(g)=2NH3(g).
①已知:
化学键 | H-H | N≡N | N-H |
键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是________________________________________。
②若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,达到平衡时NH3浓度的范围是____________________。
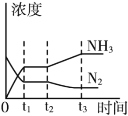
③如图表示该反应在t1时刻达到化学平衡,在t2时因改变某个条件而发生变化的情况,则t2时刻改变条件可能是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L N2所含原子的数目为NA
B.1mol/L的CaCl2溶液中含Cl的数目为2NA
C.2.4gMg与足量盐酸完全反应时,失去电子的数目为0.2NA
D.常温常压下,48g O3和O2的混合气体中,含有分子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___________
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝-空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。
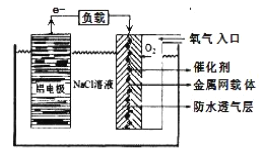
该电池的正极反应方程式为 _____;电池中NaCl溶液的作用是 ______;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为_______L。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为___________
(4)同主族的元素应用广泛。2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
①基态Ga原子价电子排布式____,核外电子占据最高能级的电子云形状为____;基态As原子最高能层上有____个电子。
②镓失去电子的逐级电离能(单位:kJ/mol)的数值依次为577、1985、2962、6192,-1由此可推知镓的主要化合价为_____和+3,砷的第一电离能比镓_____填“大”或“小”)。
③第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为____。
④砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为 ______,AsH3分子的空间构型为______。
⑤相同压强下,AsH3的沸点_______NH3(填“大于”或“小于”),原因为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com