
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L N2所含原子的数目为NA
B.1mol/L的CaCl2溶液中含Cl的数目为2NA
C.2.4gMg与足量盐酸完全反应时,失去电子的数目为0.2NA
D.常温常压下,48g O3和O2的混合气体中,含有分子的数目为3NA
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某废水中含有 Cr2O72-,为了处理有毒的 Cr2O72-,需要先测定其浓度:取 20 mL 废水,加入适量稀硫酸, 再加入过量的 V1 mL c1 mol·L-1(NH4)2Fe(SO4)2 溶液,充分反应(还原产物为 Cr3+)。用 c2 mol·L-1KMnO4 溶液滴定过量的 Fe2+至终点,消耗 KMnO4 溶液 V2 mL。则原废水中 c(Cr2O72-)为(用代数式表示)
A.![]() mol·L-1
mol·L-1
B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1
mol·L-1
D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给在锂离子电池发展方面作出突出贡献的三位科学家,颁奖词中说:他们创造了一个可再充电的世界。下面是最近研发的Ca-LiFePO4可充电电池的工作示意图,锂离子导体膜只允许Li+通过,电池反应为:xCa2++2LiFePO4![]() xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是

A.LiPF6-LiAsF6为非水电解质,其与Li2SO4溶液的主要作用都是传递离子
B.放电时,负极反应为:LiFePO4xe===Li1-xFePO4+xLi+
C.充电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,放电时发生Li+嵌入
D.充电时,当转移0.2 mol电子时,左室中电解质的质量减轻2.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】克霉唑为广谱抗真菌药,对多种真菌尤其是白色念珠菌具有较好的抗菌作用,其合成路线如下图:
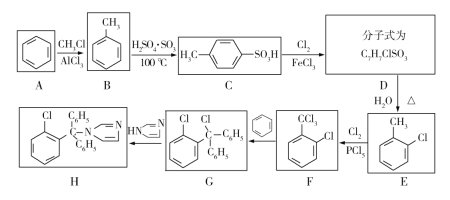
已知:甲苯与氯气在三氯化铁催化下得到两种物质:![]() 和
和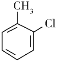 。 回答下列问题:
。 回答下列问题:
(1)E的名称是______;F中的官能团名称为______。
(2)合成克霉唑的过程中,发生最多的反应类型是______。
(3)在由B制取E的过程中,不是由B一步反应生成E,其原因为______。
(4)写出C→D的化学方程式______。
(5)M与G互为同分异构体,满足下列两个条件的M有______种(不包括G本身)
①含有三个苯环
②苯环之间不直接相连
写出其中核磁共振氢谱有5组峰,且峰面积比为2∶2∶1∶1∶1的结构简式______。
(6)结合题中信息,写出用苯为原料,制备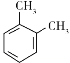 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:A.石墨和金刚石 B. 35Cl和37Cl C.CH3CH=CHCH3和(CH3)2C=CH2 D.丁烷和新戊烷E. 
(1)属于同素异形体的是__________________
(2)属于同位素的是__________________
(3)属于同分异构体的是__________________
(4)属于同系物的是__________________
(5)属于同种物质的是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰无论在实验室还是在生产、生活中均有广泛应用。工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。
(1)经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。
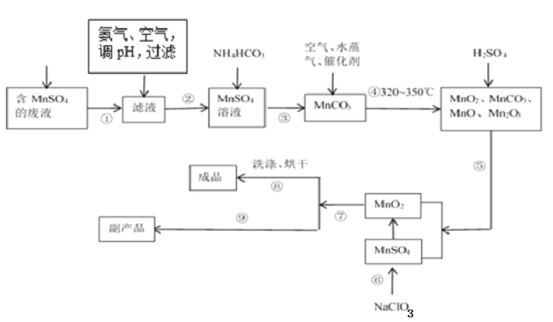
①常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在___mol/L。
化合物 | MnS | CoS(α型) | NiS |
Ksp | 2.5×10-10 | 4×10-21 | 1.07×10-21 |
②步骤⑥的化学方程式为___。
③步骤①~⑨中涉及到过滤的操作有___。(填序号)
④步骤⑨得到的副产品的化学式为___,其重要的用途之一是___。得到该副产品的操作是___。
(2)生产电解二氧化锰的原理是在93℃左右以石墨为电极电解硫酸锰和硫酸的混合溶液,写出阳极的电极反应式___,若电解过程中的电压为3V,理论上生产1tMnO2消耗电能___kw·h。(1kw·h=3.6×106J)
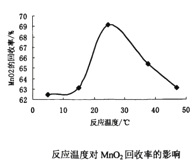
(3)双氧水氧化法制备二氧化锰时所发生的反应为MnSO4+2NH3+H2O2→MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。MnO2的回收率随着温度升高先增大后减小的可能原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )

A.该反应在T1、T3温度时达到化学平衡
B.无法判断该反应在T2温度时是否达到化学平衡
C.该反应的逆反应是吸热反应
D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
B.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212g氯气生成,则反应中电子转移的数目为5NA
C.16gO2和14C2H4的混合物中所含中子数为8NA
D.常温下,1L0.5mol/LCH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJmol-1.如图为质子膜H2S燃料电池的示意图。下列说法正确的是

A.电极a上发生的电极反应为:2H2S-4e-=S2+4H+
B.电池工作时,电流从电极a经负载流向电极b
C.当反应生成64gS2时,电池内部释放632kJ热能
D.当电路中通过4mol电子时,有4molH+经质子膜进入负极区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com