
【题目】二氧化锰无论在实验室还是在生产、生活中均有广泛应用。工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。
(1)经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。
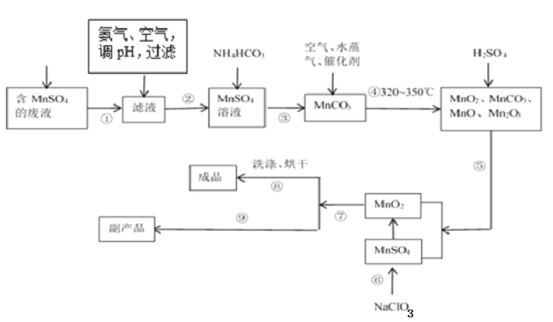
①常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在___mol/L。
化合物 | MnS | CoS(α型) | NiS |
Ksp | 2.5×10-10 | 4×10-21 | 1.07×10-21 |
②步骤⑥的化学方程式为___。
③步骤①~⑨中涉及到过滤的操作有___。(填序号)
④步骤⑨得到的副产品的化学式为___,其重要的用途之一是___。得到该副产品的操作是___。
(2)生产电解二氧化锰的原理是在93℃左右以石墨为电极电解硫酸锰和硫酸的混合溶液,写出阳极的电极反应式___,若电解过程中的电压为3V,理论上生产1tMnO2消耗电能___kw·h。(1kw·h=3.6×106J)
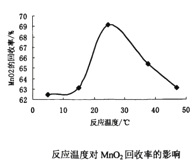
(3)双氧水氧化法制备二氧化锰时所发生的反应为MnSO4+2NH3+H2O2→MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。MnO2的回收率随着温度升高先增大后减小的可能原因是___。
【答案】4×10-16-2.5×10-10 3MnSO4+NaClO3+3H2O=3MnO2+NaCl+3H2SO4 ①②③⑤⑦⑨ (NH4)2SO4 做化肥 蒸发浓缩、冷却结晶、过滤 Mn2+-2e-+2H2O=MnO2+4H+ 1845 温度升高反应加快生成更多的MnO2,温度达到一定程度后,若在升温则氨气挥发,过氧化氢分解
【解析】
(1)①当溶液中离子浓度小于10-5mol/L时,认为完全沉淀,要将Co2+和Ni2+完全沉淀,根据Ksp的表达式计算即可;
②步骤⑥利用NaClO3将MnSO4氧化成MnO2,在溶液中NaClO3被还原成NaCl,结合得失电子守恒、原子守恒写方程式即可;
③凡是涉及固液分离的步骤都涉及过滤;
④整个过程中铵根离子和硫酸根离子没有除去,故步骤⑨得到的副产品为硫酸铵;
(2)阳极发生氧化反应,应为Mn2+失电子被氧化成MnO2;
(3)温度升高反应速率加快,但是温度太高,双氧水会分解,氨气会挥发。
(1)①根据Ksp(CoS)=c(Co2+)×c(S2-)、Ksp(NiS)=c(Ni2+)×c(S2-)得:![]() 、
、![]() ,欲使Co2+和Ni2+完全沉淀,就要将Co2+和Ni2+的浓度控制在10-5mol/及以下,那么:
,欲使Co2+和Ni2+完全沉淀,就要将Co2+和Ni2+的浓度控制在10-5mol/及以下,那么:![]() 、
、![]() ,解得c(S2-)>4×10-16、c(S2-)>1.07×10-16,又因为Mn2+浓度为1mol/L而不受损,则Mn2+和S2-还没开始沉淀,此时有c(S2-)×c(Mn2+)<Ksp(MnS),即c(S2-)×1mol/L<2.5×10-10,解得:c(S2-)<2.5×10-10,综上所述:
,解得c(S2-)>4×10-16、c(S2-)>1.07×10-16,又因为Mn2+浓度为1mol/L而不受损,则Mn2+和S2-还没开始沉淀,此时有c(S2-)×c(Mn2+)<Ksp(MnS),即c(S2-)×1mol/L<2.5×10-10,解得:c(S2-)<2.5×10-10,综上所述: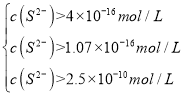 ,即:硫离子浓度在4×10-16mol/L-2.5×10-10mol/L之间,故答案为:4×10-16-2.5×10-10;
,即:硫离子浓度在4×10-16mol/L-2.5×10-10mol/L之间,故答案为:4×10-16-2.5×10-10;
②步骤⑥利用NaClO3将MnSO4氧化成MnO2,在溶液中NaClO3被还原成NaCl,方程式为:3MnSO4+NaClO3+3H2O=3MnO2+NaCl+3H2SO4,故答案为:3MnSO4+NaClO3+3H2O=3MnO2+NaCl+3H2SO4;
③①~⑨中,①②③⑤⑦⑨都涉及到固液分离,都用到过滤,故答案为:①②③⑤⑦⑨;
④整个过程中铵根离子和硫酸根离子没有除去,故步骤⑨得到的副产品为硫酸铵,可做化肥,将滤液蒸发浓缩、冷却结晶、过滤即可得到硫酸铵,故答案为:(NH4)2SO4;做化肥;蒸发浓缩、冷却结晶、过滤;
(2)阳极失电子,化合价升高,被氧化,再结合电荷守恒、原子守恒可得:Mn2+-2e-+2H2O=MnO2+4H+,生产1t MnO2转移的电子物质的量做如下计算: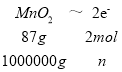 ,解得n=
,解得n=![]() , 所以电子数=
, 所以电子数=![]() ,因为每个电子带1.6×10-19C的电量,所以电子所带总电量q=
,因为每个电子带1.6×10-19C的电量,所以电子所带总电量q=![]() ×1.6×10-19,由E=qU得:E==(
×1.6×10-19,由E=qU得:E==(![]() ×1.6×10-19×3)J=
×1.6×10-19×3)J=![]() kw·h≈1845 kw·h,故答案为:Mn2+-2e-+2H2O=MnO2+4H+;1845;
kw·h≈1845 kw·h,故答案为:Mn2+-2e-+2H2O=MnO2+4H+;1845;
(3)温度升高,反应速率增大,但是温度过高,H2O2分解了,NH3挥发了,故答案为:温度升高反加快生成更多的MnO2,温度达到一定程度后,若在升温则氨气挥发,过氧化氢分解。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g) ![]() 2HI(g) △H=-9.48 k.J·mol-1
2HI(g) △H=-9.48 k.J·mol-1
②I2(s)+H2((g) ![]() 2HI(g)△H=+26.48k.J·mol-1
2HI(g)△H=+26.48k.J·mol-1
下列判断正确的是
A.254gI(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的生成物比反应②的生成物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是
A.S+O2![]() SO2
SO2
B.4NH3+5O2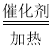 4NO+6H2O
4NO+6H2O
C.Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl
D.2C12+2Ca(OH)2=Ca(C1O)2+CaCl2 +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L N2所含原子的数目为NA
B.1mol/L的CaCl2溶液中含Cl的数目为2NA
C.2.4gMg与足量盐酸完全反应时,失去电子的数目为0.2NA
D.常温常压下,48g O3和O2的混合气体中,含有分子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,1-二环丙基乙烯(![]() )是重要医药中间体,下列关于该化合物的说法错误的是
)是重要医药中间体,下列关于该化合物的说法错误的是
A. 所有碳原子可能在同一平面B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有9种D. 生成1mol C8H18至少需要3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g)△H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
化学键 | C—H | H—H | C=O |
|
键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =____kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____,该反应工业生产适宜的温度和压强为____(填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______(计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____。
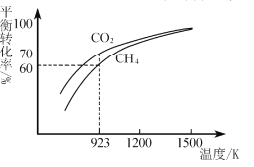
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺人O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。
①随着O2进入量的增加,热负荷下降的原因是 ____。
②掺人O2可使CH4的平衡转化率____(填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
查看答案和解析>>
科目:高中化学 来源: 题型:
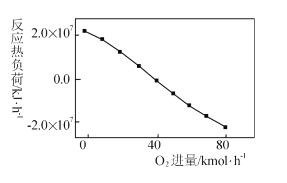
【题目】电解质溶液的电导率越大,导电能力越强。用0.100molL﹣1的NaOH溶液滴定体积均为10.00mL、浓度均为0.100molL﹣1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO﹣)+c(OH﹣)﹣c(H+)=0.05molL﹣1
C.在相同温度下,A、B、C三点溶液中水的电离程度: B<A=C
D.D点溶液中:c(Cl﹣)=2c(OH﹣)﹣2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═![]() H2(g)+
H2(g)+![]() I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______(用△H1、△H2表示);
②分析上述反应,下列判断正确的是______;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______;
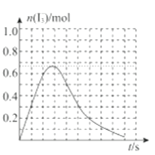
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______[用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com