
【题目】电解质溶液的电导率越大,导电能力越强。用0.100molL﹣1的NaOH溶液滴定体积均为10.00mL、浓度均为0.100molL﹣1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
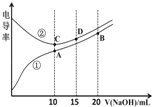
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO﹣)+c(OH﹣)﹣c(H+)=0.05molL﹣1
C.在相同温度下,A、B、C三点溶液中水的电离程度: B<A=C
D.D点溶液中:c(Cl﹣)=2c(OH﹣)﹣2c(H+)
【答案】C
【解析】
醋酸是弱电解质,0.100molL﹣1 CH3COOH溶液的电导率较小,与同浓度的NaOH溶液反应后生成强电解质,溶液中的离子总浓度变大,电导率变大;0.100molL﹣1的盐酸的电导率较大,与同浓度的与NaOH溶液反应后,溶液中的离子总浓度变小,电导率变小。因此,曲线①代表滴定CH3COOH溶液的曲线。
A. 曲线①代表滴定CH3COOH溶液的曲线,A说法正确;
B. A点溶液中,根据电荷守恒可知,c(CH3COO﹣)+c(OH﹣)=c(H+)+ c(Na+)=c(H+)+0.05molL﹣1,因此,c(CH3COO﹣)+c(OH﹣)﹣c(H+)=0.05molL﹣1,B说法正确;
C. A点为醋酸钠溶液,由于醋酸根离子水解促进水的电离,故其中水的电离程度较大;B点为醋酸钠和氢氧化钠的混合液,强碱抑制水的电离和醋酸根离子的水解,氢氧化钠的物质的量等于醋酸钠的物质的量,氢氧化钠对水的电离抑制程度大于醋酸根离子的水解程度,故其中水的电离程度较小;C点为氯化钠溶液,其中水的电离没有受到影响。因此,在相同温度下,A、B、C三点溶液中水的电离程度为B<C<A,C说法不正确;
D. D点溶液中,氯化钠的物质的量是氢氧化钠的2倍,根据物料守恒可知,2c(Na+)=3c(Cl﹣),根据电荷守恒可知,c(Cl﹣)+ c(OH﹣)=c(H+)+ c(Na+),所以2c(Cl﹣)+ 2c(OH﹣)=2c(H+)+ 2c(Na+),将2c(Na+)=3c(Cl﹣)代入其中可得2c(Cl﹣)+ 2c(OH﹣)=2c(H+)+ 3c(Cl﹣),合并同类项后得到2c(OH﹣)=2c(H+)+c(Cl﹣),所以c(Cl﹣)=2c(OH﹣)﹣2c(H+),D说法正确。
综上所述,相关说法不正确的是C。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施:
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
能提高NO2转化率的是_______(填字母)。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H=______kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K=______。
N2O4(g)的平衡常数K=______。
(4)现用一定量的Cu 与足量的浓HNO3反应,制得1.00L已达平衡的N2O4和NO2
混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰无论在实验室还是在生产、生活中均有广泛应用。工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。
(1)经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。
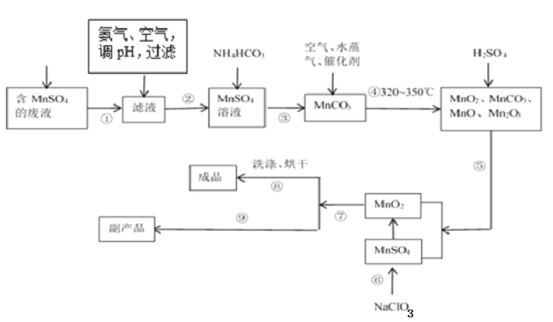
①常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在___mol/L。
化合物 | MnS | CoS(α型) | NiS |
Ksp | 2.5×10-10 | 4×10-21 | 1.07×10-21 |
②步骤⑥的化学方程式为___。
③步骤①~⑨中涉及到过滤的操作有___。(填序号)
④步骤⑨得到的副产品的化学式为___,其重要的用途之一是___。得到该副产品的操作是___。
(2)生产电解二氧化锰的原理是在93℃左右以石墨为电极电解硫酸锰和硫酸的混合溶液,写出阳极的电极反应式___,若电解过程中的电压为3V,理论上生产1tMnO2消耗电能___kw·h。(1kw·h=3.6×106J)
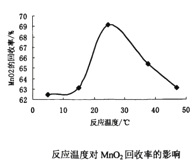
(3)双氧水氧化法制备二氧化锰时所发生的反应为MnSO4+2NH3+H2O2→MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。MnO2的回收率随着温度升高先增大后减小的可能原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11,则该温度下水的KW=_______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va:Vb=___________。
(2)25℃时,0.1mol/L的HaA溶液中c(H+)/c(OH-)=1010,请回答下列问题:
①HaA是___________(填“强电解质”或“弱电解质”)。
②在加水稀释HaA溶液的过程中,随着水量的增加而增大的是__________(填字母)
A.c(HaA) B.c(H+)/c(HaA) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③NanA溶液显__________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
B.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212g氯气生成,则反应中电子转移的数目为5NA
C.16gO2和14C2H4的混合物中所含中子数为8NA
D.常温下,1L0.5mol/LCH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: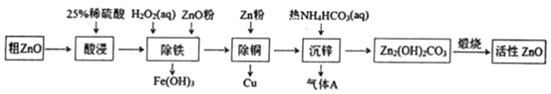
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用勒夏特列原理解释的是
A. 配制FeCl3溶液
配制FeCl3溶液
B. 酯水解程度比较
酯水解程度比较
C. 探究石灰石与稀盐酸在密闭环境下的反应
探究石灰石与稀盐酸在密闭环境下的反应
D. 卤化银沉淀的转化
卤化银沉淀的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
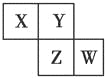
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 氢化物的稳定性:X>Y>Z
D. 四种元素的单质中,Z单质的熔、沸点最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com