
【题目】下列实验操作或现象不能用勒夏特列原理解释的是
A. 配制FeCl3溶液
配制FeCl3溶液
B. 酯水解程度比较
酯水解程度比较
C. 探究石灰石与稀盐酸在密闭环境下的反应
探究石灰石与稀盐酸在密闭环境下的反应
D. 卤化银沉淀的转化
卤化银沉淀的转化
【答案】B
【解析】
A. Fe3+发生水解:Fe3++3H2O![]() Fe(OH)3+3H+,将FeCl3溶于浓盐酸中,可以抑制Fe3+水解,能够用勒夏特列原理解释,故A不符合题意;
Fe(OH)3+3H+,将FeCl3溶于浓盐酸中,可以抑制Fe3+水解,能够用勒夏特列原理解释,故A不符合题意;
B. 酯的水解中,稀硫酸作催化剂,催化剂不影响平衡,不能用勒夏特列原理解释,故B符合题意;
C. 碳酸钙与盐酸反应生成CO2,CO2在水中存在溶解平衡,塞上瓶塞时,压强增大,促进CO2的溶解,不会有气泡生成,打开瓶塞后压强减小,生成气泡,,可用勒夏特列原理解释,故C不符合题意;
D. AgNO3与NaCl发生AgNO3+NaCl=AgCl↓+NaNO3,NaCl过量,AgNO3完全反应,AgCl在溶液中存在溶解平衡,加入少量的KI溶液后生成黄色沉淀,该沉淀为AgI,说明实现了沉淀的转化,能够用勒夏特列原理解释,故D不符合题意;
答案:B。


科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是
A.S+O2![]() SO2
SO2
B.4NH3+5O2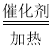 4NO+6H2O
4NO+6H2O
C.Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl
D.2C12+2Ca(OH)2=Ca(C1O)2+CaCl2 +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100molL﹣1的NaOH溶液滴定体积均为10.00mL、浓度均为0.100molL﹣1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
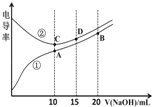
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO﹣)+c(OH﹣)﹣c(H+)=0.05molL﹣1
C.在相同温度下,A、B、C三点溶液中水的电离程度: B<A=C
D.D点溶液中:c(Cl﹣)=2c(OH﹣)﹣2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质之间的变化体现了化学之美。
(1)一定条件下,含氮元素的物质可发生如图所示的循环转化。
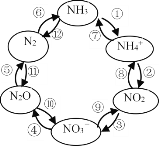
Ⅰ.图中属于“氮的固定”的是_______(填序号,下同);转化过程中发生非氧化还原反应的是_______________。
Ⅱ.反应④是在酸性条件下由NO3-与镁作用实现,则该反应的离子方程式为_______。
(2)H2S气体与CuCl2、FeCl3溶液发生一系列反应如图所示:
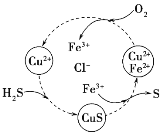
①转化图中化合价不变的元素是__________(写名称)。
②转化图中生成S单质的离子方程式为____________。
(3)A、B、C、D、E、F、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
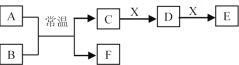
①若A为常见的金属单质,焰色反应呈黄色,B常温下为液态,X能使品红溶液褪色,则C和E反应的离子方程式为________。
②若D为两性氢氧化物,F为非金属单质,则X成分可能为____(写化学式,下同)。
③若A为红棕色气体,X为金属单质,溶液D中加入KSCN溶液变红。则E为______,F为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,表中a-f代表六种短周期主族元素,完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_____________(填元素编号)。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性___________(选填“强”、“弱”)
(4)若b为非金属元素,则以下推断正确的是___________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═![]() H2(g)+
H2(g)+![]() I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______(用△H1、△H2表示);
②分析上述反应,下列判断正确的是______;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
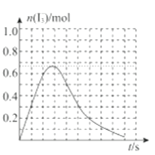
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______;
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______[用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上亚硝酸钠可用作媒染剂、缓蚀剂等。实验室以铜、浓硝酸、氢氧化钠为原料制备亚硝酸钠的装置如图所示(部分夹持装置略)。已知:NO和NO2均能被酸性KMnO4溶液氧化为NO3-。
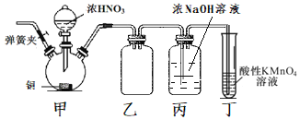
(1)连接装置后首先要进行的操作是___,然后装入药品。
(2)装置甲中反应的离子方程式为___。
(3)装置乙的作用是___。
(4)实验结束后,打开甲装置的弹簧夹,通入N2,其目的是___。
(5)装置丁的作用是___。
(6)为了测定丙中NaNO2的浓度,取丙中溶液20.00mL,用0.1000mol/L的酸性KMnO4溶液进行滴定,消耗KMnO4溶液10.00mL。请回答:
①酸性KMnO4溶液盛放在___滴定管中。
②判断滴定达终点时的依据为___。
③写出上述反应的离子方程式___,计算出NaNO2的浓度为___mol/L。
④配制酸性KMnO4溶液定容时,俯视容量瓶的刻度线,NaNO2的浓度___。(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某矿渣(成分为NiFe2O4、NiO、FeO、CaO、SiO2等)中回收NiSO4的工艺流程如图:
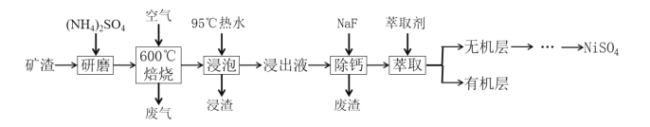
已知①600℃时发生反应:NiFe2O4+4H2SO4═NiSO4+Fe2(SO4)3+4H2O
②Ksp(CaF2)=4.0×10-11
回答下列问题:
(1)将NiFe2O4写成氧化物的形式为__;(NH4)2SO4的作用是__。
(2)“焙烧”时矿渣中部分FeO反应生成Fe2(SO4)3的化学方程式为__。
(3)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有__(写化学式)。
(4)向“浸出液”中加入NaF以除去Ca2+,当溶液中c(F-)=2.0×10-3molL-1时,若除钙率为99%,则原“浸出液”中c(Ca2+)=__gL-1。
(5)“萃取”后,分离得到无机层的操作为__,用到的主要玻璃仪器是__。
(6)将“浸渣”进一步处理后,利用以下流程可得到高铁酸盐。K2FeO4是倍受关注的一类新型、高效、无毒的多功能水处理剂。回答下列问题:
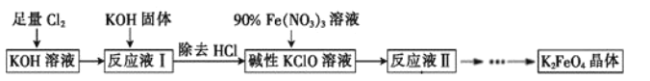
①反应液Ⅰ和90%Fe(NO3)3溶液反应的离子方程式为__。
②反应液Ⅱ经过蒸发浓缩、冷却结晶、过滤可得到K2FeO4晶体,流程中的碱用KOH而不用NaOH的原因是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com