
【题目】下列不属于氧化还原反应的是
A.S+O2![]() SO2
SO2
B.4NH3+5O2 4NO+6H2O
4NO+6H2O
C.Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl
D.2C12+2Ca(OH)2=Ca(C1O)2+CaCl2 +2H2O
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫等危害。在2L恒容密闭容器中一定条件下发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g);起始 CO 物质的量为 10 mol,10 min 达平衡,CO 物质的量变为 8 mol,此条件下该反应的平衡常数 K = 0.1。下列说法不正确的是
COS(g)+H2(g);起始 CO 物质的量为 10 mol,10 min 达平衡,CO 物质的量变为 8 mol,此条件下该反应的平衡常数 K = 0.1。下列说法不正确的是
A.升高温度,H2S 浓度增加,表明该反应是放热反应
B.10 min 内平均速率:v(COS)=0.1 mol·L-1·min-1
C.反应前 H2S 物质的量为 5 mol
D.CO 的平衡转化率为 20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施:
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
能提高NO2转化率的是_______(填字母)。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H=______kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K=______。
N2O4(g)的平衡常数K=______。
(4)现用一定量的Cu 与足量的浓HNO3反应,制得1.00L已达平衡的N2O4和NO2
混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。回答下列问题:
(1)已知1000 K时,下列反应的平衡常数和反应热:
①CH4(g) ![]() C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1
②2CO(g) ![]() C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3
④CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) K4 ΔH4(SMR)则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
CO2(g)+4H2(g) K4 ΔH4(SMR)则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5 ppm以下。脱硫的目的为______________。
(3)下图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知ΔH4____0(填“>”或“<”)。
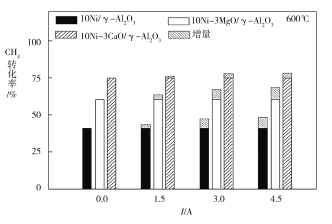
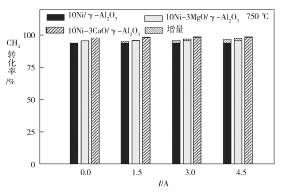
(4)下图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐____________(填“增加”“减小”或“不变”),600 ℃时,电流对三种催化剂中的____________(用图中的催化剂表示式回答)影响效果最为显著,当温度高于750 ℃时,无论电流强度大小,有无催化剂,H2产率趋于相同,其原因是______________。

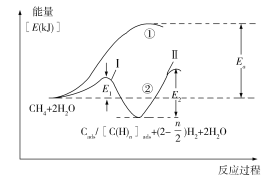
(5)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2–![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】克霉唑为广谱抗真菌药,对多种真菌尤其是白色念珠菌具有较好的抗菌作用,其合成路线如下图:
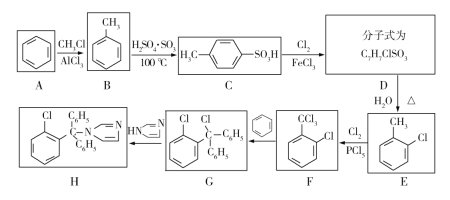
已知:甲苯与氯气在三氯化铁催化下得到两种物质:![]() 和
和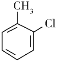 。 回答下列问题:
。 回答下列问题:
(1)E的名称是______;F中的官能团名称为______。
(2)合成克霉唑的过程中,发生最多的反应类型是______。
(3)在由B制取E的过程中,不是由B一步反应生成E,其原因为______。
(4)写出C→D的化学方程式______。
(5)M与G互为同分异构体,满足下列两个条件的M有______种(不包括G本身)
①含有三个苯环
②苯环之间不直接相连
写出其中核磁共振氢谱有5组峰,且峰面积比为2∶2∶1∶1∶1的结构简式______。
(6)结合题中信息,写出用苯为原料,制备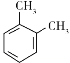 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和 NaHCO3的叙述正确的是
A.常温下,Na2CO3的溶解度比 NaHCO3小
B.Na2CO3溶液显碱性, NaHCO3溶液显酸性
C.可用加热的方法除去 NaHCO3中混有的Na2CO3杂质
D.与足量盐酸反应得到等量的CO2时,消耗 NaHCO3的质量比Na2CO3少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰无论在实验室还是在生产、生活中均有广泛应用。工业上可以用制备对苯二酚的废液为原料生产二氧化锰。此工艺对节约资源、保护环境、提高经济效益有着重要意义。
(1)经分析知该废液中含有硫酸锰、硫酸铵、硫酸以及Fe2+、Co2+、Ni2+等金属离子。以此为原料制备化学二氧化锰的流程如图所示。
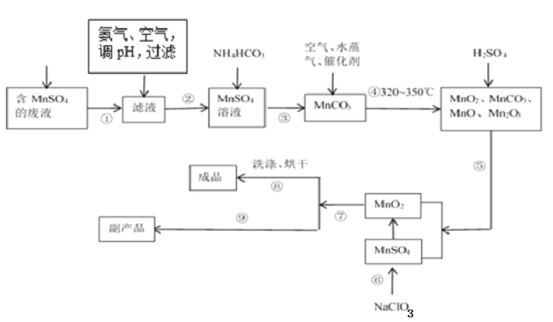
①常温下几种有关难溶硫化物的溶度积常数如下表,若除去Fe2+后的废液中Mn2+浓度为1mol/L,欲使Co2+和Ni2+完全沉淀,而Mn2+不受损失,S2-的浓度范围应控制在___mol/L。
化合物 | MnS | CoS(α型) | NiS |
Ksp | 2.5×10-10 | 4×10-21 | 1.07×10-21 |
②步骤⑥的化学方程式为___。
③步骤①~⑨中涉及到过滤的操作有___。(填序号)
④步骤⑨得到的副产品的化学式为___,其重要的用途之一是___。得到该副产品的操作是___。
(2)生产电解二氧化锰的原理是在93℃左右以石墨为电极电解硫酸锰和硫酸的混合溶液,写出阳极的电极反应式___,若电解过程中的电压为3V,理论上生产1tMnO2消耗电能___kw·h。(1kw·h=3.6×106J)
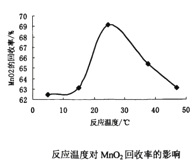
(3)双氧水氧化法制备二氧化锰时所发生的反应为MnSO4+2NH3+H2O2→MnO2+(NH4)2SO4,在溶液的pH、过氧化氢的用量和反应时间一定的情况下,温度对实验结果的影响如图所示。MnO2的回收率随着温度升高先增大后减小的可能原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=11,则该温度下水的KW=_______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va:Vb=___________。
(2)25℃时,0.1mol/L的HaA溶液中c(H+)/c(OH-)=1010,请回答下列问题:
①HaA是___________(填“强电解质”或“弱电解质”)。
②在加水稀释HaA溶液的过程中,随着水量的增加而增大的是__________(填字母)
A.c(HaA) B.c(H+)/c(HaA) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③NanA溶液显__________(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用勒夏特列原理解释的是
A. 配制FeCl3溶液
配制FeCl3溶液
B. 酯水解程度比较
酯水解程度比较
C. 探究石灰石与稀盐酸在密闭环境下的反应
探究石灰石与稀盐酸在密闭环境下的反应
D. 卤化银沉淀的转化
卤化银沉淀的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com