
����Ŀ��������N2H4��������������һ����Ҫ�Ļ��ȼ�ϣ�N2H4��N2O4�ܷų��������ȡ�
��1����֪��2NO2(g)��N2O4(g) ��H����57.20kJ��mol��1��һ���¶��£����ܱ������з�Ӧ2NO2(g)��N2O4(g) �ﵽƽ�⡣������������ʱ�����д�ʩ��
A����СNO2��Ũ�� B�������¶� C������NO2��Ũ�� D�������¶�
�����NO2ת���ʵ���_______������ĸ����
��2��25��ʱ��1.00gN2H4(l)������N2O4(l)��ȫ��Ӧ����N2(g)��H2O (l) ���ų�19.14kJ
����������Ӧ2N2H4(l)+N2O4(l)��3N2(g)+4H2O (l)����H��______kJ��mol��1��
��3��17����1.01��105Pa���ܱ�������N2O4��NO2�Ļ������ﵽƽ��ʱ��c(NO2)��0.0300mol��L��1��c(N2O4)��0.0120mol��L��1�����㷴Ӧ2 NO2(g)![]() N2O4(g)��ƽ�ⳣ��K=______��
N2O4(g)��ƽ�ⳣ��K=______��
��4������һ������Cu ��������ŨHNO3��Ӧ���Ƶ�1.00L�Ѵ�ƽ���N2O4��NO2
������壨17����1.01��105Pa��������������������Cu��������________��
���𰸡�BC ��1224.96 13.3 1.73g
��������
��1�����ڸ÷�ӦΪ���������С�ķ��ȷ�Ӧ��Ҫ���NO2ת���ʣ���Ӧ�ò�ȡ���������¶ȣ�������NO2��Ũ�ȣ�������ѹǿ�ȴ�ʩ������B��C����Ҫ��
��2����1.00gN2H4(l)�ų�19.14kJ����2mol(��64g)N2H4(l)����Ϊ1224.96kJ��������H��1224.96kJ��mol��1��
��3������������֪��ƽ��ʱc(N2O4)��0.0120mol��L��1��c(NO2)��0.0300mol��L��1��K��c(N2O4)/c2(NO2) ��0.0120/0.0300��0.0300 ��13.3��
��4���ɣ�3����֪����17����1.01��105Pa�ﵽƽ��ʱ��1.00L��������У�n(N2O4)��c(N2O4)��V��0.0120mol��L��1��1.00L��0.0120mol��n(NO2)��c(NO2)��V��0.0300mol��L��1��1.00L��0.0300mol����n��(NO2)��n(NO2)��2��n(N2O4)��0.0540mol����Cu��4HNO3��Cu(NO3)2��2NO2����2H2O�ɵã�m(Cu)�� 64g��mol��1��0.0540mol/2 ��1.73g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦNH4Cl+NaNO2![]() NaCl+N2��+2H2O�����Ҳ������壬�����ڶ���ʯ�Ϳ��ɡ����б�ʾ��Ӧ��������Ļ�ѧ������ȷ����
NaCl+N2��+2H2O�����Ҳ������壬�����ڶ���ʯ�Ϳ��ɡ����б�ʾ��Ӧ��������Ļ�ѧ������ȷ����
A. ������Ϊ18����ԭ�ӣ�![]()
B. N2�Ľṹʽ��N=N
C. Na+�Ľṹʾ��ͼ�� 
D. H2O�ĵ���ʽ�� ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ������£�NCl3��һ����״Һ�壬����ӿռ乹����NH3���ƣ����ж�NCl3��NH3���й�������ȷ����( )
A. ������N��Cl��������CCl4������C��Cl���������
B. NCl3�����ǷǼ��Է���
C. NBr3��NCl3�ӷ�
D. �ڰ�ˮ�У���NH3��H2O�����(����������ʾ)����γ�NH3��H2O���ӣ���NH3��H2O�ĽṹʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������������ء�����˵���������![]()
![]()
A.��ĭ�����������һ������Ҳ�����ڵ������
B.��ɫ��ѧҪ���Դͷ�����������������Ի�������Ⱦ
C.��¯ˮ���к��е�![]() ��������
��������![]() ��Һ�������������ȥ
��Һ�������������ȥ
D.����ˮ����þ����ֹ�ڵ���ʴ��ԭ������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���˿�ѧ�Һ������Ŷ��з�����ֽ����� (��ͼ)������һ���п��һ��ƶ������̵ij��������ʹ��ӡˢ��ѹ�㼼�����һ�ſ�����ü���С������ֽ������Ƚ�Ϊ0.5���ף��������������Ͳü���ֽ�ڵ�������������ˮ������п��ɵ��Һ������ܷ�ӦʽΪ�� Zn+2MnO2+H2O=ZnO+2MnO(OH)������˵����ȷ����

A.�õ�ص���������Ϊп
B.�õ�ط�Ӧ�ж������̷�����������Ӧ
C.��ص�������ӦʽΪ2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.����0.1molп�ܽ�ʱ���������Һ�ĵ�����Ϊ1.204��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� Al2(SO4)3�� MgSO4�Ļ����Һ�У��μ� NaOH��Һ�����ɳ������������ NaOH ��Һ�������ϵ��ͼ��ʾ����ԭ���Һ��Al2(SO4)3�� MgSO4�����ʵ���Ũ��֮��Ϊ

A.1��1
B.1��2
C.2��1
D.3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ��
��I2(g)+H2(g) ![]() 2HI(g) ��H=-9.48 k.J��mol-1
2HI(g) ��H=-9.48 k.J��mol-1
��I2(s)+H2((g) ![]() 2HI(g)��H=+26.48k.J��mol-1
2HI(g)��H=+26.48k.J��mol-1
�����ж���ȷ����
A.254gI(g)��ͨ��2gH2(g)����Ӧ����9.48kJ
B.1mol��̬����1mol��̬���������������17.00kJ
C.��Ӧ�ڵķ�Ӧ���������ȷ�Ӧ�ٵķ�Ӧ����������
D.��Ӧ�ٵ�������ȷ�Ӧ�����������ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����������ԭ��Ӧ����
A.S+O2![]() SO2
SO2
B.4NH3+5O2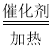 4NO+6H2O
4NO+6H2O
C.Na2SiO3+2HCl=H2SiO3�����壩+2NaCl
D.2C12+2Ca��OH��2=Ca��C1O��2+CaCl2 +2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ�ĵ絼��Խ��������Խǿ����0.100molL��1��NaOH��Һ�ζ������Ϊ10.00mL��Ũ�Ⱦ�Ϊ0.100molL��1 �������CH3COOH��Һ�����ô�������õζ���������Һ�ĵ絼����ͼ��ʾ������˵������ȷ���ǣ�������
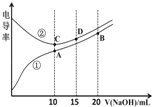
A.���ߢٴ����ζ�CH3COOH��Һ������
B.A����Һ�У�c(CH3COO��)+c(OH��)��c(H+)��0.05molL��1
C.����ͬ�¶��£�A��B��C������Һ��ˮ�ĵ���̶ȣ� B��A=C
D.D����Һ�У�c(Cl��)��2c(OH��)��2c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com