
【题目】表为元素周期表的一部分,表中a-f代表六种短周期主族元素,完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_____________(填元素编号)。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性___________(选填“强”、“弱”)
(4)若b为非金属元素,则以下推断正确的是___________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
【答案】d ![]() Cl 弱 ③
Cl 弱 ③
【解析】
表中六种元素都为短周期元素,则a,b,c为第二周期元素,且三元素在周期表中左右相邻;d,e,f为第三周期元素,且三元素在周期表中左右相邻,在进行元素性质分析时,可将元素在周期中进行定位,也可利用金属性和非金属的分界进行判断。
(1)六种元素中,原子半径最大的元素是电子层数多,同周期元素从左到右半径减小,半径最大的元素位于左下方,即为d;
(2)若a的气态氢化物的水溶液呈碱性,为氨气,氮的最外层有5个电子,与三个氢原子形成三对共用电子对,剩余一对孤对电子,氨气的电子式:![]() ,当a为N元素时,b为O,c为F,d是P,e是S,f是Cl,这些元素中,非金属性最强的是Cl,最高价氧化物对应的水化物酸性最强的是HClO4;
,当a为N元素时,b为O,c为F,d是P,e是S,f是Cl,这些元素中,非金属性最强的是Cl,最高价氧化物对应的水化物酸性最强的是HClO4;
(3)若f元素的原子L层电子数比M层电子数多1个,则f为Cl,e为S,非金属性则S元素的非金属性比Cl元素的非金属性弱;
(4)若b为非金属元素,依据金属性和非金属性的分界线进行判断,c和f一定是非金属元素,
①a位于b的前面,可能是金属元素,也可能是非金属元素,故①错误;
②d位于b的左下方,可能是金属元素,也可能是非金属元素,故②错误;
③若b为非金属元素,f位于它的对角线位置,一定是非金属元素,故③正确。


科目:高中化学 来源: 题型:
【题目】克霉唑为广谱抗真菌药,对多种真菌尤其是白色念珠菌具有较好的抗菌作用,其合成路线如下图:
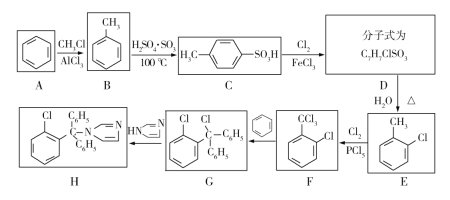
已知:甲苯与氯气在三氯化铁催化下得到两种物质:![]() 和
和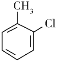 。 回答下列问题:
。 回答下列问题:
(1)E的名称是______;F中的官能团名称为______。
(2)合成克霉唑的过程中,发生最多的反应类型是______。
(3)在由B制取E的过程中,不是由B一步反应生成E,其原因为______。
(4)写出C→D的化学方程式______。
(5)M与G互为同分异构体,满足下列两个条件的M有______种(不包括G本身)
①含有三个苯环
②苯环之间不直接相连
写出其中核磁共振氢谱有5组峰,且峰面积比为2∶2∶1∶1∶1的结构简式______。
(6)结合题中信息,写出用苯为原料,制备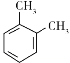 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是
A.56g铁在足量氧气中完全燃烧,转移的电子数小于3NA
B.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212g氯气生成,则反应中电子转移的数目为5NA
C.16gO2和14C2H4的混合物中所含中子数为8NA
D.常温下,1L0.5mol/LCH3COONH4溶液的pH=7,则溶液中CH3COO-与NH4+的数目均为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: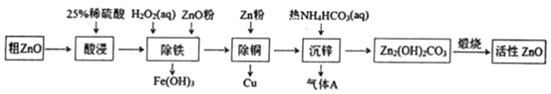
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂。通过如下简化流程既脱除燃媒尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
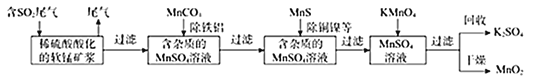
请回答下列问题:
(1)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是______(填编号);
A.NaOH溶液、酚酞溶液 B.稀H2SO4酸化的KMnO4溶液 C.碘水、淀粉溶液 D.氨水、酚酞溶液
(2)写出软锰矿浆吸收SO2的化学方程式______;
(3)用MnCO3,能除去溶液中的Al3+和Fe3+,用原理解释:______。
(4)写出KMnO4与MnSO4溶液反应的离子方程式______;
(5)工业上将K2MnO4溶液采用惰性电极隔膜法电解,可制得KMnO4.装置如图:
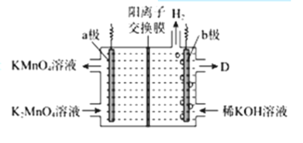
①D是溶液______;
②结合电极反应式简述生成KMnO4的原理:______;
(6)除杂后得到的MnSO4溶液可以通过______(填操作名称)、过滤制得硫酸锰晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用勒夏特列原理解释的是
A. 配制FeCl3溶液
配制FeCl3溶液
B. 酯水解程度比较
酯水解程度比较
C. 探究石灰石与稀盐酸在密闭环境下的反应
探究石灰石与稀盐酸在密闭环境下的反应
D. 卤化银沉淀的转化
卤化银沉淀的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJmol-1.如图为质子膜H2S燃料电池的示意图。下列说法正确的是

A.电极a上发生的电极反应为:2H2S-4e-=S2+4H+
B.电池工作时,电流从电极a经负载流向电极b
C.当反应生成64gS2时,电池内部释放632kJ热能
D.当电路中通过4mol电子时,有4molH+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如图所示。下列说法正确的是( )
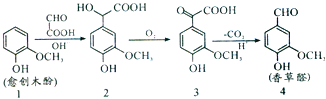
A.反应1→2中发生了取代反应
B.化合物2在一定条件下可发生缩聚反应
C.检验制得的香草醛中是否混有化合物3可用银氨溶液
D.等物质的量的四种化合物分别与足量H2反应,消耗H2物质的量之比为3:4:5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
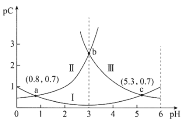
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中![]()
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,![]() 的值先增大后减小
的值先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com