
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂。通过如下简化流程既脱除燃媒尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
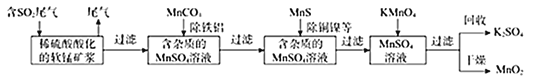
请回答下列问题:
(1)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是______(填编号);
A.NaOH溶液、酚酞溶液 B.稀H2SO4酸化的KMnO4溶液 C.碘水、淀粉溶液 D.氨水、酚酞溶液
(2)写出软锰矿浆吸收SO2的化学方程式______;
(3)用MnCO3,能除去溶液中的Al3+和Fe3+,用原理解释:______。
(4)写出KMnO4与MnSO4溶液反应的离子方程式______;
(5)工业上将K2MnO4溶液采用惰性电极隔膜法电解,可制得KMnO4.装置如图:
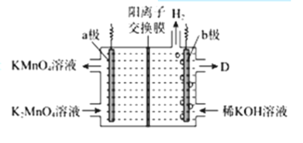
①D是溶液______;
②结合电极反应式简述生成KMnO4的原理:______;
(6)除杂后得到的MnSO4溶液可以通过______(填操作名称)、过滤制得硫酸锰晶体。
【答案】BC MnO2+SO2=MnSO4 消耗溶液中氢离子,促进Al3+和Fe3+水解生成氢氧化物沉淀 2MnO4-+3Mn2++2H2O=5MnO2+4H+ 浓KOH溶液 a极上发生MnO42--e-═MnO4-,部分钾离子通过阳离子交换膜进入阴极区,阳极区生成KMnO4 蒸发浓缩、冷却结晶
【解析】
由流程可知,含二氧化硫的尾气通入稀硫酸酸化的软锰矿浆中,二氧化硫能被二氧化锰氧化为硫酸锰,MnCO3能除去溶液中Al3+和Fe3+,MnS能将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰、硫酸钾。
(1)二氧化硫可被高锰酸钾、碘水氧化,根据颜色变化,可准确判断滴定终点,从而准确测定其含量,而与碱反应时选酚酞作指示剂,吸收不彻底,不能准确测定二氧化硫的含量。答案为:BC;
(2)锰矿浆吸收SO2,生成硫酸锰,反应的化学方程式为MnO2+SO2=MnSO4。答案为:MnO2+SO2=MnSO4;
(3)在水溶液中,Al3+和Fe3+都能水解生成H+,MnCO3能与H+反应从而促进Al3+和Fe3+完全转化为氢氧化物沉淀,从而除去溶液中的Al3+和Fe3+。用原理解释为消耗溶液中氢离子,促进Al3+和Fe3+水解生成氢氧化物沉淀。答案为:消耗溶液中氢离子,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(4)KMnO4与MnSO4溶液发生归中反应,生成MnO2沉淀,反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+。答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(5)①由图可知,a电极上MnO42-失去电子,b电极上水电离出的氢离子得到电子生成OH-,左侧溶液中的K+通过阳离子交换膜进入右侧溶液,所以右侧KOH的浓度变大,D是浓KOH溶液。答案为:浓KOH溶液;
②a为阳极,阳极上K2MnO4失去电子发生氧化反应,电极反应式为MnO42--e-═MnO4-,部分钾离子通过阳离子交换膜进入阴极区,阳极区生成KMnO4。答案为:a极上发生MnO42--e-═MnO4-,部分钾离子通过阳离子交换膜进入阴极区,阳极区生成KMnO4;
(6)由MnSO4溶液得到MnSO4H2O晶体,应蒸发浓缩、冷却结晶、过滤及干燥。答案为:蒸发浓缩、冷却结晶。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】化学反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10mol/LNa2S2O3溶液与0.10mol/L 稀H2SO4反应速率的影响。反应方程式为:Na2S2O3 +H2SO4=Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | A | 10.0 | y |
③ | 0 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为____________,乙是实验需要测量的物理量,则表格中“乙”为____________,x、y、z的大小关系是____________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g)+3H2(g)=2NH3(g).
①已知:
化学键 | H-H | N≡N | N-H |
键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是________________________________________。
②若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,达到平衡时NH3浓度的范围是____________________。
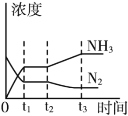
③如图表示该反应在t1时刻达到化学平衡,在t2时因改变某个条件而发生变化的情况,则t2时刻改变条件可能是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为___。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表的___区。
(3)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
(4)铁元素能于CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为___。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
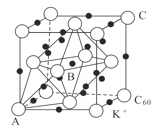
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为___,晶胞参数为428pm,则晶体密度为___g/cm3(NA表示阿伏加德罗常数的值,列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___________
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝-空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。
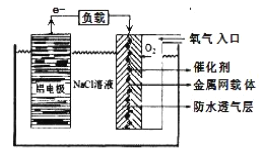
该电池的正极反应方程式为 _____;电池中NaCl溶液的作用是 ______;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为_______L。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为___________
(4)同主族的元素应用广泛。2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
①基态Ga原子价电子排布式____,核外电子占据最高能级的电子云形状为____;基态As原子最高能层上有____个电子。
②镓失去电子的逐级电离能(单位:kJ/mol)的数值依次为577、1985、2962、6192,-1由此可推知镓的主要化合价为_____和+3,砷的第一电离能比镓_____填“大”或“小”)。
③第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为____。
④砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为 ______,AsH3分子的空间构型为______。
⑤相同压强下,AsH3的沸点_______NH3(填“大于”或“小于”),原因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定.
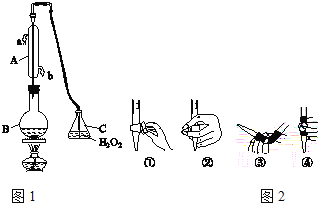
(1)仪器A的名称是_____,水通入A的进口为_____。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____。
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_____(填数字编号);若滴定终点时溶液的pH=8.8,则选择的指示剂为_____;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:_____g/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,表中a-f代表六种短周期主族元素,完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_____________(填元素编号)。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性___________(选填“强”、“弱”)
(4)若b为非金属元素,则以下推断正确的是___________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验现象预测正确的是


A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中有红色沉淀生成
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.30gC2H6含共价键的数目为7NA
B.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
C.0.1mol/L氨水中含有OH-的数目为0.1NA
D.一定条件下,0.1molN2与足量H2反应生成NH3,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法错误的是
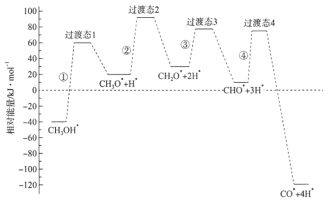
A.②中包含C—H键的断裂过程
B.该历程中能垒(反应活化能)最小的是③
C.该历程中制约反应速率的方程式为CH3O*+3H* CO*+4H*
D.由此历程可知:![]() △H<0
△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com