
【题目】中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定.
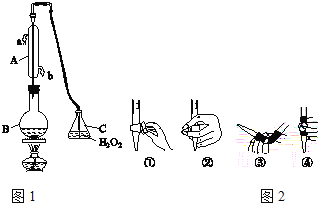
(1)仪器A的名称是_____,水通入A的进口为_____。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____。
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_____(填数字编号);若滴定终点时溶液的pH=8.8,则选择的指示剂为_____;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:_____g/L。
【答案】冷凝管或冷凝器 b SO2+H2O2=H2SO4 ③ 酚酞 ④ 0.24
【解析】
由题中信息可知,葡萄酒中加入适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,SO2还原性较强,可以被H2O2氧化为硫酸,然后用标准NaOH溶液滴定该溶液,可以测出葡萄酒中SO2的含量。
(1)根据仪器A的结构可知其为冷凝管或冷凝器,其用于冷凝回流易挥发的液体,为提高冷凝效率,冷却水通入A的进口为下口,即b口.
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,SO2还原性较强,可以被H2O2氧化为硫酸,其化学方程式为SO2+H2O2=H2SO4.
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,标准液要装在碱式滴定管中,滴定前排气泡时,应选择图2中的③;若滴定终点时溶液的pH=8.8,溶液呈弱碱性,为了减小实验误差,故选择的指示剂为酚酞;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,由于50mL刻度下方还有一段没有刻度的管子,则管内液体的体积大于40mL,故选④项。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中n(SO2)= n(H2SO4)=0.5n(NaOH)=0.525.0010-3L0.0900mol/L=1.12510-3mol,SO2含量为![]() g/L。
g/L。


科目:高中化学 来源: 题型:
【题目】25℃时,水中存在电离平衡:H2O ![]() H++OH-△H>0。下列叙述正确的是
H++OH-△H>0。下列叙述正确的是
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
C.向水中加入少量NH4Cl固体,平衡正向移动,溶液呈碱性
D.向0.1mol/L的醋酸溶液中加入一定量醋酸钠晶体,溶液中c(OH-)增大,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为:___。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
写出联氨和N2O4作为火箭推进剂反应的热化学方程式(△H用含△H1,△H2,△H3的代数式表示)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是( )

A.过程Ⅰ反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程Ⅱ,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液并加热,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是
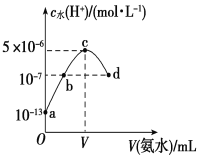
A.c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
B.b点所示溶液中:c(NH4+)=2 c(SO42-)
C.V=40
D.该硫酸的浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂。通过如下简化流程既脱除燃媒尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
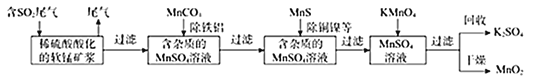
请回答下列问题:
(1)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是______(填编号);
A.NaOH溶液、酚酞溶液 B.稀H2SO4酸化的KMnO4溶液 C.碘水、淀粉溶液 D.氨水、酚酞溶液
(2)写出软锰矿浆吸收SO2的化学方程式______;
(3)用MnCO3,能除去溶液中的Al3+和Fe3+,用原理解释:______。
(4)写出KMnO4与MnSO4溶液反应的离子方程式______;
(5)工业上将K2MnO4溶液采用惰性电极隔膜法电解,可制得KMnO4.装置如图:
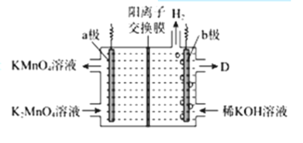
①D是溶液______;
②结合电极反应式简述生成KMnO4的原理:______;
(6)除杂后得到的MnSO4溶液可以通过______(填操作名称)、过滤制得硫酸锰晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Ai2O3、 Fe2O3 、FeO等)为铝源,制备PFAS的工艺流程如下:

(1)“碱溶”时,Ai2O3发生反应的化学方程式____________ 。
(2)“酸溶II”时 ,Fe3O4发生反应的离子方程式为_________
(3)“滤渣I”、“滤渣II”在本流程中能加以利用的是________
(4)酸度对絮凝效果和水质有显著影响。若产品PFAS中残留硫酸过多,使用时产生的不良后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.78克镁铝的混合物投入到25mL30.625%稀硫酸(密度为1.28g/cm3)中,充分反应,在标准状态下得到气体体积0.896L(气体基本上全部收集),在反应后的溶液中加入4mol/L NaOH溶液,使镁离子完全沉淀,铝离子沉淀完全消失.通过计算回答下列问题:
(1)稀硫酸的物质的量浓度为______mol/L
(2)混合物中铝的质量为______。
(3)反应后溶液中加入4mol/L NaOH溶液的体积至少为多少毫升才能使氢氧化铝和氢氧化镁沉淀分开?______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com