
【题目】25℃时,水中存在电离平衡:H2O ![]() H++OH-△H>0。下列叙述正确的是
H++OH-△H>0。下列叙述正确的是
A.将水加热,Kw增大,pH不变
B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低
C.向水中加入少量NH4Cl固体,平衡正向移动,溶液呈碱性
D.向0.1mol/L的醋酸溶液中加入一定量醋酸钠晶体,溶液中c(OH-)增大,Kw不变
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的FuNvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂lmolNN吸收167kJ热量,生成1molN≡N放出945kJ热量。根据以上信息,下列说法正确的是( )
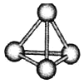
A.N4属于由非极性键构成的极性分子
B.氮元素非金属性比磷强,可知N4沸点比P4高
C.1molN4气体转变为N2气体放出888kJ热量
D.N4与N2互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大。A原子的阴离子的电子排布式与基态锂离子的相同,A和E位于同主族,基态B原子核外有3个能级且各能级上容纳的电子数相等,基态D原子有2个未成对电子,最外能层符号为L。+1价F离子的3d能级达到全充满结构。
回答下列问题:
(1)基态C原子价电子排布图为_____。
(2)B、C、D三种元素第一电离能由大到小排序为_____(填元素符号,下同),它们的电负性由小到大排序为_____。
(3)C、F组成的晶体的晶胞如图1所示。已知该晶体密度为ρg·cm-3,NA代表阿伏加德罗常数,则C、F最近的核间距为_____cm。
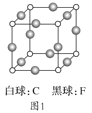
(4)A和E组成晶体,其晶胞如图2所示。E粒子周围有_____个E紧密相邻且最近;连接与E等距离且最近的A粒子构成的形状是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水时,下列叙述正确的是
A.正极产生氯气,负极产生氢气B.阳极得到的气体能使碘化钾溶液变蓝
C.在阳极区滴入酚酞试液,溶液显红色D.阳极得到氯气,阴极得到钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除了酸以外,某些盐也能溶解沉淀。利用如表三种试剂进行实验,相关分析不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
B.向①中加入酚酞显红色说明物质的“不溶性”是相对的
C.向①中加入③沉淀溶解,说明Mg(OH)2比NH3·H2O更难电离
D.①、③混合后发生反应:Mg(OH)2(s)+2NH4+![]() Mg2++2NH3·H2O
Mg2++2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和化学反应的限度是化学反应原理的重要组成部分。
(1)探究反应条件对0.10mol/LNa2S2O3溶液与0.10mol/L 稀H2SO4反应速率的影响。反应方程式为:Na2S2O3 +H2SO4=Na2SO4+S↓+SO2↑+H2O。设计测定结果如下:
编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲/mL | H2SO4溶液/mL | 乙 |
① | 25 | 10.0 | 0 | 10.0 | x |
② | 25 | 5.0 | A | 10.0 | y |
③ | 0 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究浓度对化学反应速率的影响,则a为____________,乙是实验需要测量的物理量,则表格中“乙”为____________,x、y、z的大小关系是____________。
(2)氨气具有广泛的用途,工业上合成氨的反应是N2(g)+3H2(g)=2NH3(g).
①已知:
化学键 | H-H | N≡N | N-H |
键能kJ/mol(断开1mol化学键所需要的能量) | 436 | 945 | 391 |
则合成氨的热化学方程式是________________________________________。
②若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,达到平衡时NH3浓度的范围是____________________。
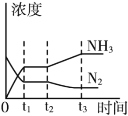
③如图表示该反应在t1时刻达到化学平衡,在t2时因改变某个条件而发生变化的情况,则t2时刻改变条件可能是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)二氧化硫一空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图:

①质子的流动方向为________________(“从A到B”或“从B到A”)。
②负极的电极反应式为________________。
(2)工业上吸收和转化SO2的电解装置示意图如下(A.B均为惰性电极):
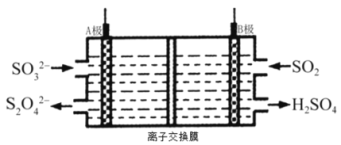
①B极接电源的________________极(“负”或“正”)。
②A极的电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列研究目的和示意图相符的是( )
选项 | A | B | C | D |
研究目的 | 密闭容器中,压强对反应:2SO2(g)+O2(g) | 固定容积的密闭容器中,温度对反应:N2(g)+3H2(g) | 等质量Na、K分别与足量水反应 | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:CO(g)+H2O(g) |
示意图 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定.
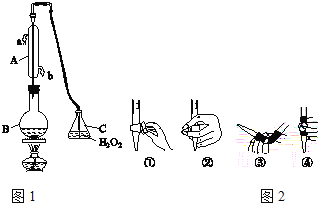
(1)仪器A的名称是_____,水通入A的进口为_____。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____。
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_____(填数字编号);若滴定终点时溶液的pH=8.8,则选择的指示剂为_____;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10mL,②=40mL,③<10mL,④>40mL)。
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:_____g/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com