
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJmol-1.如图为质子膜H2S燃料电池的示意图。下列说法正确的是

A.电极a上发生的电极反应为:2H2S-4e-=S2+4H+
B.电池工作时,电流从电极a经负载流向电极b
C.当反应生成64gS2时,电池内部释放632kJ热能
D.当电路中通过4mol电子时,有4molH+经质子膜进入负极区
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L N2所含原子的数目为NA
B.1mol/L的CaCl2溶液中含Cl的数目为2NA
C.2.4gMg与足量盐酸完全反应时,失去电子的数目为0.2NA
D.常温常压下,48g O3和O2的混合气体中,含有分子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)___________
(2)铝电池性能优越,在现代生产、生活中有广泛的应用。铝-空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。
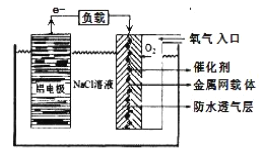
该电池的正极反应方程式为 _____;电池中NaCl溶液的作用是 ______;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为_______L。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为___________
(4)同主族的元素应用广泛。2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
①基态Ga原子价电子排布式____,核外电子占据最高能级的电子云形状为____;基态As原子最高能层上有____个电子。
②镓失去电子的逐级电离能(单位:kJ/mol)的数值依次为577、1985、2962、6192,-1由此可推知镓的主要化合价为_____和+3,砷的第一电离能比镓_____填“大”或“小”)。
③第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为____。
④砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为 ______,AsH3分子的空间构型为______。
⑤相同压强下,AsH3的沸点_______NH3(填“大于”或“小于”),原因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表的一部分,表中a-f代表六种短周期主族元素,完成下列填空:
a | b | c |
d | e | f |
(1)六种元素中,原子半径最大的是_____________(填元素编号)。
(2)若a的气态氢化物的水溶液呈碱性,则a的气态氢化物的电子式是________;六种元素中,最高价氧化物对应水化物的酸性最强的是_________(填元素符号)
(3)若f元素的原子L层电子数比M层电子数多1个,则e元素的非金属性比f元素的非金属性___________(选填“强”、“弱”)
(4)若b为非金属元素,则以下推断正确的是___________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验现象预测正确的是


A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中有红色沉淀生成
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生活中应用广泛,含有碘离子的溶液需回收处理。
(1)“硫碘循环”法是分解水制备氢气的研究热点,涉及下列三个反应:
反应Ⅰ:SO2(g)+I2(aq)+2H2O(l)═2HI(aq)+H2SO4(aq)△H1
反应Ⅱ:HI(aq)═![]() H2(g)+
H2(g)+![]() I2(aq)△H2
I2(aq)△H2
反应Ⅲ:2H2SO4(aq)═2SO2(g)+O2(g)+2H2O(l)
①反应:SO2(g)+2H2O(l)═H2SO4(aq)+H2(g)的△H═______(用△H1、△H2表示);
②分析上述反应,下列判断正确的是______;
A.反应Ⅲ易在常温下进行
B.反应I中SO2还原性比HI强
C.循环过程中需补充H2O
D.循环过程中产生1molO2同时产生1molH2
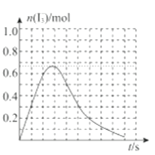
③反应I发生时,溶液中存在如下平衡:I2(aq)+I-(aq)I3-(aq),其反应速率极快且平衡常数大。现将1mol SO2.缓缓通入含1molI2的水溶液中至恰好完全反应。溶液中I3-的物质的量n(I3-)随反应时间(t)的变化曲线如图所示。开始阶段n(I3-)逐渐增大的原因是:______;
(2)用海带提取碘时,需用氯气将碘离子氧化成单质。酸性条件下,若氯气过量还能将碘单质进一步氧化成碘酸根离子(IO3-),写出氯气与碘单质反应的离子方程式:______;
(3)氯化银复合吸附剂也可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s)AgI(s)+Cl-(aq),反应达到平衡后溶液中c(I-)═______[用c(Cl-)、Ksp(AgCl)和Ksp(AgI)表示].该方法去除碘离子的原理是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.30gC2H6含共价键的数目为7NA
B.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
C.0.1mol/L氨水中含有OH-的数目为0.1NA
D.一定条件下,0.1molN2与足量H2反应生成NH3,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C10H10O2有如图的转化关系:
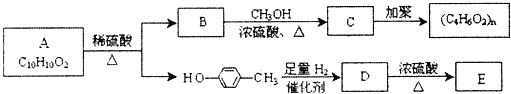
已知:E能使Br2的CCl4溶液褪色。请回答下列问题:
(1)分别写出A、C和E的结构简式:A:__;C:__;E:__。
(2)若有机物F与C互为同分异构体,则与有机物B互为同系物的F的同分异构体有__种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)主要存在于煤、石油和天然气中,会造成设备腐蚀、环境污染,更危害人体健康。目前,我国已经实现了在催化剂(γ-Al2O3)、低温条件下的精度脱除COS,如图为天然气中脱除COS反应流化床示意图:
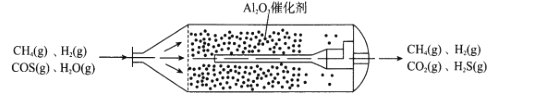
(1)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g) △H1=+6.2kJmol-1
H2S(g)+CO(g) △H1=+6.2kJmol-1
H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2=+41.2kJmol-1
H2O(g)+CO(g) △H2=+41.2kJmol-1
则COS精度脱除反应H2O(g)+COS(g)![]() H2S(g)+CO2(g)的△H=__kJmol-1。
H2S(g)+CO2(g)的△H=__kJmol-1。
②将H2O与COS以体积比1:2置于恒温恒容密闭容器中反应,若测得该反应平衡时H2O与COS的体积比1:6,则该温度下,脱除反应的平衡常数K=__(保留两位小数)。
(2)T℃时,以一定流速、不同物质的量的H2O(g)和COS(g)通过流化床,测得COS(g)脱除速率变化关系如图。
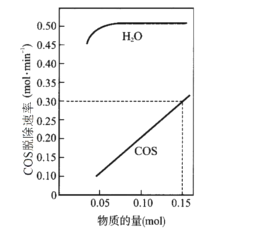
已知:COS脱除反应机理如下,其中吸附在催化剂表面的物种用*标注。
a.吸附:H2O→H2O*
b.反应:COS+H2O*→CO2+H2S*
c.脱附:H2S*→H2S
①若COS(g)脱除速率v=knx(COS)ny(H2O)(molmin-1),由图中的数据可算出x、k的值:x=__,k=__。
②“吸附”步骤为__(填“快反应”或“慢反应”),理由是__。
③脱除反应的决速步骤为__(填“a”、“b”或“c”)。
④少量氢气可以抑制催化剂积硫(S*)中毒,分析该流化床中可能存在的可逆反应是__。
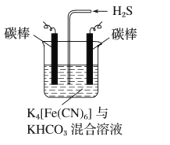
(3)工业上常采用下图所示电解装置,将气态废弃物中的硫化氢转化为可利用的硫。首先通电电解K4[Fe(CN)6]与KHCO3的混合溶液,通电一段时间后,再向所得溶液通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S═2[Fe(CN)6]4-+2HCO3-+S↓.电解过程中阴极区电极反应式为_。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com