
【题目】下列说法中正确的是 ( )
A.硫是一种不溶于水的淡黄色固体
B.硫与金属反应时作氧化剂,与非金属反应时作还原剂
C.硫与铁反应时生成硫化铁
D.硫在自然界中仅以化合态存在
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -112 kJ·mol-1,
2SO2(g)+ O2 (g) 2SO3(g) △H= -196 kJ·mol-1;
SO2通常在NO2的存在下,进一步被氧化,生成SO3。写出NO2和SO2反应的热化学方程式为________________________________。
(2)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中a极要连接电源的_______(填“正”或“负”)极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
(3)常温下,烟气中SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_____________________________________(写出主要反应的离子方程式),该溶液中c(Na+)_________ 2c(SO32-)+ c(HSO3-)(填“>”“<”或“=”);
②常温下,0.1mol/L的NaHSO3溶液的pH=6,则c(SO32-)- c(H2SO3)= _________ mol/L(填写准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起世界各国的广泛重视。在爆炸的核电站周围含有放射性物质碘131和铯137。碘131一旦被人体吸入,可能会引发甲状腺疾病。
(1)Cs(铯)的价电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ·mol-1) | 520 | 496 | 419 |
上述三种元素X、Y、Z的元素符号分别为________,基态Z原子的核外电子排布式为________,X形成的单质晶体中含有的化学键类型是________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BCl3分子中B—Cl键的键角为________。
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有________个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻________个I-。

甲 乙
(5)KI晶体的密度为ρ g·cm-3,K和I的摩尔质量分别为MK g·mol-1和MIg·mol-1,原子半径分别为rKpm和rIpm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是( )
A. 反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B. 用铁片与稀硫酸反应制H2,改用98%的浓硫酸可加快生成H2的速率
C. 用锌片与稀盐酸反应,加入适量的NaCl溶液,反应速率不变
D. 反应2SO2(s)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
(1)X、Z两种元素的元素符号为X________,Z________。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________________。
(3)①由X、Y、Z所形成的常见离子化合物是__________________(写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________。
③化合物WY3的晶体结构中含有的化学键为________(选填序号)。
A.只含离子键 B.只含共价键 C.既含离子键又含共价键
④X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
(4)用电子式表示化合物W2Z的形成过程:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关“未来金属”钛的信息有:①硬度大②熔点高③常温下耐酸碱、耐腐蚀④铁矿炼钛的一种工业流程为:
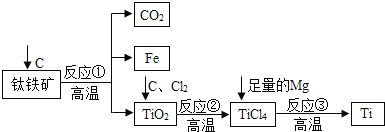
(1)钛铁矿的主要成分是FeTiO3(钛酸亚铁),其中钛的化合价为_______价,反应①化学方程式为_____________
(2)TiCl4在高温下与足量Mg反应生成金属Ti,反应③化学方程式为_________,属于______(填反应类型),该反应_____(填“能”或“不能”)说明Mg的金属活动性强于Ti.
(3)上述冶炼方法得到的金属钛中会混有少量金属单质是______(填名称),由前面提供的信息 ______(填序号)知,除去它的试剂可以是以下试剂中的_________(填序号)
A:HClB:NaOHC:NaClD:H2SO4
(4)氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2 ====2TiCl4+2X+6CO,则X的化学式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中,一定是同系物的是( )
A. C3H6和2—甲基—1—丁烯 B. 3,3—二甲基—1—丁炔和3—甲基—1—戊炔
C. ![]() 和
和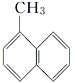 D. C4H10和C9H20
D. C4H10和C9H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题
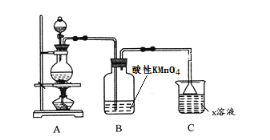
(1)利用上图装置研究铜与浓硫酸反应,A装置反应的化学方程式为_________________。B装置反应的化学方程式为__________________________,C装置的作用是_________________________。
(2)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是__________________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为____________________。
验证该气体的实验方案如下:

①装置连接顺序:X→ _________________________;
②能证明上述假设成立的实验现象是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将图1所示的装置中盐桥换成铜导线与两石墨棒连接得到图2所示装置,并将NaCl溶液换为HCl溶液,发现电流表指针仍然有偏转,下列说法正确的是( )

A. 图1盐桥中的阳离子移向甲装置
B. 两图都是将化学能转变成电能的装置
C. 图2中乙装置总反应的离子方程式:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
D. 图2中电子流向为Fe→电流计![]() 石墨→石墨b→石墨c→Fe
石墨→石墨b→石墨c→Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com