
����Ŀ������ͼ��ʾ���������̶��������������������ƶ���M��N���������о�������Ӧ��A(g)��3B(g)![]() 2C(g) ��H����192 kJ��mol��1����M��N�У��ֱ�ͨ��x mol A��y mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䡣����˵����ȷ���ǣ� ��
2C(g) ��H����192 kJ��mol��1����M��N�У��ֱ�ͨ��x mol A��y mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䡣����˵����ȷ���ǣ� ��
![]()
A. ��ƽ��ʱA�������������е����������ȣ���xһ������y
B. ��x��y��1��2����ƽ��ʱ��M�е�ת���ʣ�A>B
C. ��x��y��1��3����M�зų�����172.8 kJʱ��A��ת����Ϊ90%
D. ��x��1.2��y��1��N�дﵽƽ��ʱ���Ϊ2 L������C 0.4 mol����ͨ��0.36 mol Aʱ��v��<v��
���𰸡�A
��������A�
A(g) �� 3B(g)![]() 2C(g)
2C(g)
��ʼ/molxy0
Mƽ��/molx��ay��3a2a
Nƽ��/molx��by��3b2b
��![]() ��
��
��x��y����ȷ��
B�M��ת���ʣ���(A)��![]() ��(B)��
��(B)��![]()
��x��y��1��2����(A)��![]() ��(B)��
��(B)��![]() ��(A)<��(B)������
��(A)<��(B)������
C�A(g)��3B(g)![]() 2C(g)Q
2C(g)Q
1 mol 192 kJ
m172.8 kJ
m��![]() ��0.9 mol
��0.9 mol
����x��ֵ��ȷ��������A��ת���ʲ�ȷ��������
D� A(g) �� 3B(g)![]() 2C(g)
2C(g)
��ʼ/mol 1.2 1 0
ƽ��/mol 1.0 0.4 0.4

K>Qc������v��>v��������


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���ij�ݻ�һ�����ܱ������У��������л�ѧƽ�⣺C(s)+H2O(g)![]() CO(g)+H2(g)������ȷ���������淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬���ǣ�������
CO(g)+H2(g)������ȷ���������淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬���ǣ�������
A. ��ϵ��ѹǿ���ٷ����仯
B. v��(CO)=v��(H2)
C. 1 mol H��H�����ѵ�ͬʱ����2 mol H��O��
D. ����n mol CO��ͬʱ����n mol H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���A��B��C��Ϊͬ���칹�壬����C��H��O����Ԫ����ɣ��ҷ�����C��H��OԪ�ص�������Ϊ15:2:8������Է�������ͨ���������Ϊ100����֪������A�ܷ���������Ӧ������ֱ���ṹ����������3�ֲ�ͬ��ѧ�������⣬��ԭ�Ӹ�����Ϊ1:1:2��BΪ��Ԫ������C�ĺ�����ױ���������д��ڼ����������ʵ�ת����ϵ���£�

���������գ�
��1��A�ķ���ʽ��______________��A�����еĹ�����������_________________��
��2��B��G�Ľṹ��ʽ�ֱ���_____________��_____________��
��3��D��C��Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
��4���ɵ���F�����Ӿ۷�Ӧ���ɵIJ���Ľṹ��ʽ��___________��
��5�������һ����![]() Ϊ��Ҫԭ���Ʊ�
Ϊ��Ҫԭ���Ʊ�![]() �ĺϳ�·��_____�����ϳ�·�߳��õı�ʾ��ʽΪ����
�ĺϳ�·��_____�����ϳ�·�߳��õı�ʾ��ʽΪ����![]() ��
��![]()
![]() Ŀ����
Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������NOCl�����ںϳ������ȡ�������Cl2��NO�ڳ��³�ѹ�ºϳɣ������۵�Ϊ-64.5�棬�е�Ϊ-5.5�棬�������ǻ�ɫ���ж����壬��ˮ��ˮ�⡣ �밴Ҫ��ش�����������⣺
(1)������м��ϡ�����ַ�Ӧ�Ʊ�NO�����ӷ���ʽΪ��______________________��
(2)�Ʊ�NOCl��װ������ͼ��ʾ������˳��Ϊ:a��_________________________(�������������ҷ�����Сд��ĸ��ʾ)��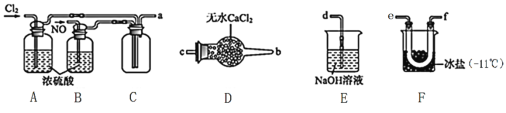
��װ��A��B�����Ǣٸ���NO��Cl2����___________________________________________��
��װ��D��������______________________________________��
��װ��E��NOCl������Ӧ�Ļ�ѧ����ʽΪ________________��
(3)��ҵ����������NOβ�����������ж��֣����м�ӵ绯ѧ������ԭ����ͼ��ʾ��

�ù����������ĵ缫��ӦʽΪ��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶�ʱ����2.0 L�����ܱ������г���2 mol SO2��1 mol O2��������Ӧ��2SO2(g) �� O2(g)![]() 2SO3(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
2SO3(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
t / s | 0 | t1 | t2 | t3 | t4 |
n(SO3) / mol | 0 | 0��8 | 1��4 | 1.8 | 1.8 |
����˵����ȷ����
A����Ӧ��ǰt1s ��ƽ������v(O2) = 0.4/t1mol��L��1��s��1
B�����������������䣬���ѹ����1.0 L��ƽ�ⳣ��������
C����ͬ�¶��£���ʼʱ�������г���4 mol SO3���ﵽƽ��ʱ��SO3��ת���ʴ���10%
D�������¶Ȳ��䣬����������ٳ���2 mol SO2��1 mol O2����Ӧ�ﵽ��ƽ��ʱn(SO3)/n(O2)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��Ӧ 2Mg+CO2 ![]() 2MgO+C��H��0 ���ر�Ƕȿ������Է�����
2MgO+C��H��0 ���ر�Ƕȿ������Է�����
B. ���ܱ������������淴Ӧ��2NO(g)+2CO(g)N2(g)+2CO2(g)��H=��113.0kJ/mol���ﵽƽ������¶Ȳ�������С������������´ﵽƽ�������H ��С
C. ���� HClO �� Ka=3.0��108��H2CO3 �� Ka1=4.3��107��Ka2=5.6��1011�����Ʋ���ͬ״�� �£���Ũ�ȵ� NaClO �� Na2CO3 ��Һ�У�pH ǰ��С�ں���
D. ��֪��Ksp(AgCl)=1.8��1010��Ksp(Ag2CrO4)=2.0��1012���������Ũ��Ϊ1.0��10��4mol/L �� AgNO3 ��Һ���뵽Ũ�Ⱦ�Ϊ 1.0��10��4mol/L �� KCl �� K2CrO4 �Ļ����Һ�в������ֲ�ͬ�������� Ag2CrO4 �����Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��һ�������Դ����ұ�𡢵��������ϵ�����Ӧ�ù㷺����ش��������⣺
(1)ij�����Ŷ�������Ĥ���N2��H2�Ĺ���ԭ����ͼ����ʾ(������N2��O2�����ʵ���֮�Ȱ�4��1��)�����������У�ĤI��������������ʵ���֮��n(H2)��n(N2)=3��1����CH4��H2O��O2��Ӧ�Ļ�ѧ����ʽΪ______________________��

(2)��H2��CO�ϳɼ״����Ȼ�ѧ����ʽΪCO(g)+2H2(g) ![]() CH3OH (g) ��H1����֪��CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ��H2=��49.0kJ��mol��1��CO(g)+H2O(g)==CO2(g)+H2(g) ��H3=��41.1k J��mol��1�����H1=___________ k J��mol��1��
CH3OH (g) ��H1����֪��CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ��H2=��49.0kJ��mol��1��CO(g)+H2O(g)==CO2(g)+H2(g) ��H3=��41.1k J��mol��1�����H1=___________ k J��mol��1��
(3)���ݻ��ɱ���ܱ������г���1 mol CO��2.2molH2���ں��º�ѹ�����·�����ӦCO(g)+2H2(g)![]() CH3OH(g)��ƽ��ʱ��CO��ת����[��(CO)]���¶ȡ�ѹǿ�ı仯�����ͼ����ʾ��
CH3OH(g)��ƽ��ʱ��CO��ת����[��(CO)]���¶ȡ�ѹǿ�ı仯�����ͼ����ʾ��

��ѹǿ��p1___________(����>��<������=��)p2��
��M��ʱ��H2��ת����Ϊ___________(��������ȷ��0.1%)���÷�Ӧ��ƽ�ⳣ��Kp=___________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
�۲�ͬ�¶��£��÷�Ӧ��ƽ�ⳣ���Ķ���ֵ(lgK)��ͼ����ʾ�����У�A��Ϊ506Kʱƽ�ⳣ���Ķ���ֵ����B��C��D��E�ĵ�������ȷ��ʾ�÷�Ӧ��lgK���¶�(T)�Ĺ�ϵ����___________��
(4)H2��ԭNO�ķ�ӦΪ2NO(g)+2H2(g)![]() N2(g)+2H2O(1)��ʵ���÷�Ӧ���ʵı���ʽΪv=kcm(NO)��cn(H2)(k�����ʳ�����ֻ���¶��й�)
N2(g)+2H2O(1)��ʵ���÷�Ӧ���ʵı���ʽΪv=kcm(NO)��cn(H2)(k�����ʳ�����ֻ���¶��й�)
��ij�¶��£���Ӧ�����뷴Ӧ��Ũ�ȵı仯��ϵ���±���ʾ��
��� | c(H2)/(mol/L) | c(NO)/(mol/L) | v/(mol/Lmin) |
1 | 0.10 | 0.10 | 0.414k |
2 | 0.10 | 0.20 | 1.656k |
3 | 0.50 | 0.10 | 2.070k |
�ɱ������ݿ�֪��m=___________��n=___________��
��������Ӧ���������У�i��2NO(g)+H2(g)==N2(g)+H2O2(1)(����Ӧ)��ii��H2O2(1)+H2(g)==2H2O(1)(�췴Ӧ)������������ȷ����___________(����ĸ)
A��H2O2�Ǹ÷�Ӧ�Ĵ���
B����Ӧi�Ļ�ܽϸ�
C���ܷ�Ӧ�����ɷ�Ӧii�����ʾ���
D����Ӧi��NO��H2����ײ��������Ч
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ������ʾ�����ʼ�ת������ʵ�ֵ���
A. Ca(OH)2![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
B. SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
C. FeS2![]() SO2
SO2![]() (NH4)2SO4
(NH4)2SO4
D. ����NaCl��Һ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��̵Ļ�ѧ���������ȷ����
A. ������ͭ��Һ��ȥ��Ȳ�е��������壺H2S + Cu2+=== CuS�� + 2H+
B. ���Ȼ�����Һ�е��������ˮ��Al3+ + 4OH- === AlO2- + 2H2O
C. �õ���ʽ��ʾNa��Cl�γ�NaCl�Ĺ��̣�![]()
D. ���������绯ѧ��ʴ��������Ӧ��Fe-3e- === Fe3+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com