
����Ŀ��������֬��һ�ֳ�Ĥ�Ժõ���֬��������һ�ִ�����֬�ĺϳ���·��
��֪��RCH2CH=CH2![]()
![]()
��1���л���A�к��еĹ�������____________����֣���д��B�Ľṹ��ʽ��______________��E�ķ���ʽΪ_____________________��
��2���ٵĻ�ѧ����ʽ��____________________________________������_______��Ӧ��
��3����Ӧ��-��������ȡ����Ӧ����________������ţ���
��4����Ӧ�ܵĻ�ѧ����ʽΪ��________________________________________��
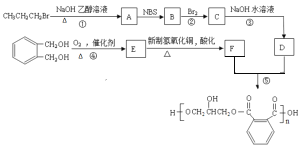
��5��д������������������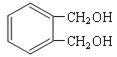 ��Ϊͬ���칹��Ľṹ��ʽ ______________��
��Ϊͬ���칹��Ľṹ��ʽ ______________��
a�������Ȼ�����Һ������ɫ
b��ͨ���˴Ź����֣�������ֻ�����ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ1��1
c���ܷ�����ȥ��Ӧ
���𰸡�̼̼˫�� CH2=CHCH2Br C8H6O2 CH3CH2CH2Br+NaOH ![]() CH3CH=CH2
CH3CH=CH2 ![]() +NaBr+H2O ��ȥ��Ӧ ��
+NaBr+H2O ��ȥ��Ӧ �� 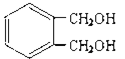 +O2
+O2![]()
 +2 H2O
+2 H2O 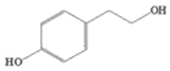
��������
�������̿�֪��CH3CH2CH2Br��NaOH�Ĵ���Һ���ȵ������·�����ȥ��Ӧ������A��ΪCH3CH=CH2��������֪��A��NBS������Ӧ����̼̼˫������̼ԭ��������һ����ԭ�ӣ���B�Ľṹ��ʽΪCH2=CHCH2Br��B���巢���ӳɷ�Ӧ������C���ṹ��ʽΪCH2BrCHBrCH2Br��C����������ˮ��Һ��ˮ�����ɱ���������D��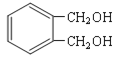 �����������ڱ�����ȩ���������Ƶ�������ͭ��Ӧ�����ڱ������ᣬ��F��
�����������ڱ�����ȩ���������Ƶ�������ͭ��Ӧ�����ڱ������ᣬ��F��
��1��������֪���л���A�Ľṹ��ʽΪCH3CH=CH2�����еĹ�����Ϊ̼̼˫����B�Ľṹ��ʽΪCH2=CHCH2Br��E�Ľṹ��ʽΪ![]() �������ʽΪC8H6O2��
�������ʽΪC8H6O2��
��2����ΪCH3CH2CH2Br��NaOH�Ĵ���Һ���ȵ������·�����ȥ��Ӧ������ʽΪCH3CH2CH2Br+NaOH ![]() CH3CH=CH2
CH3CH=CH2 ![]() +NaBr+H2O��
+NaBr+H2O��
��3����Ӧ��Ϊ��ȥ��Ӧ����Ӧ��Ϊ�ӳɷ�Ӧ����Ӧ��Ϊȡ����Ӧ����Ӧ��Ϊ������Ӧ����Ϊ�ۣ�
��4����Ӧ��Ϊ���ǻ��Ĵ�����������ʽΪ![]() + O2
+ O2![]()
![]() +2H2O��
+2H2O��
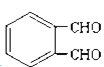
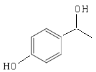
��5��![]() �ķ���ʽΪC8H10O2��a�������Ȼ�����Һ������ɫ�����жϺ��б������ǻ������ǻ��뱽��ֱ��������b��ͨ���˴Ź����֣�������ֻ�����ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ1��1����������2��ȡ��������Ϊ�Գƽṹ��c���ܷ�����ȥ��Ӧ����һ����ԭ��Ϊ�ǻ�����ṹ��ʽΪ
�ķ���ʽΪC8H10O2��a�������Ȼ�����Һ������ɫ�����жϺ��б������ǻ������ǻ��뱽��ֱ��������b��ͨ���˴Ź����֣�������ֻ�����ֲ�ͬ��ѧ�������⣬�ҷ������Ϊ1��1����������2��ȡ��������Ϊ�Գƽṹ��c���ܷ�����ȥ��Ӧ����һ����ԭ��Ϊ�ǻ�����ṹ��ʽΪ![]() ��
�� ��
��


 ����ѧ����ϵ�д�
����ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɳ����ԭ�����͵���
A. Fe��SCN��3��Һ�м������KSCN����ɫ����
B. �غ�ɫBr2������ѹ����ɫ����
C. SO2��������SO3�ķ�Ӧ��������Ҫʹ�ô���
D. H2��I2��HIƽ��������ѹ����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�����������
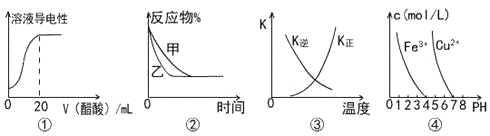
A.ͼ�ٱ�ʾ��20 mL 0.1 mol/L��ˮ����μ���0.1 mol/L���ᣬ��Һ�����������������ı仯
B.ͼ�ڱ�ʾѹǿ�Կ��淴ӦA(g)+2B(g)![]() 3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
3C(g)+D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ��
C.ͼ�������߱�ʾ��Ӧ3A(g) + B(g)![]() 2C��g����H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2C��g����H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
D.��ͼ�ܣ���Ҫ��ȥCuSO4��Һ�е�Fe3+���ɼ���NaOH��Һ��pH��4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ѧ���õ���扲�����ͭ��װ��ͼ��ʾ���˹����ϵͳ��ʵ������CO2��H2OΪԭ���Ʊ�CH4��O2�����й�˵������ȷ����( )
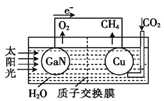
A. ��װ��ֻ�л�ѧ��ת��Ϊ����
B. �����ص缫������
C. �����о���2mol�ĵ��ӣ������ص缫����lmol O2
D. ͭ�缫����ĵ缫��Ӧʽ��CO2+8e-+8H+=CH4+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�����ͼ��ʾװ���Ʊ�һ�����ױ���

ʵ�鲽�����£�
������Ũ�����Ũ����(�������1��3)�Ļ����(����)��
��������ƿ��װ15 mL�ױ���
��װ������ҩƷ������װ��������
��������ƿ�м�����ᣬ�����Ͻ��裻
�ݿ����¶ȣ���Լ��Ӧ10����������ƿ���д���Һ��(����ɫ��״)���֣�
�����һ�����ױ���(��֪���ױ����ܶ�Ϊ0.866 g��cm��3���е�Ϊ110.6 �棻���������ܶ�Ϊ1.20 g��cm��3���е�Ϊ210.9 ��)
��������ʵ�飬�ش��������⣺
(1)ʵ�鷽����ȱ��һ����Ҫ������������________����ʵ��Ĺؼ��ǿ����¶���30 �����ң�����¶ȹ��ߣ������ĺ����__________________________��
(2)�������ƻ���ķ�����________________________________��Ũ�����������_________________��
(3)L����������________����ˮ����________��
(4)д���ױ�����ᷴӦ���ɶ������ױ��Ļ�ѧ����ʽ��______________����Ӧ����Ϊ��________��
(5)�����Ʒ�������£�

����1��������________��
(6)���ⶨ����Ʒ1�ĺ˴Ź�����������3���壬����ṹ��ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2A��ˮ�д�������ƽ�⣺H2A=H++HA-��HA-![]() H++A2-��
H++A2-��
��1��NaHA��Һ��pH___(����ڡ�С�ڻ����)Na2A��Һ��pH��
��2��ij�¶��£�����0.1mol/L��NaHA��Һ����εμ�0.1mol/LKOH��Һ����Һ�����ԡ���ʱ�û����Һ�����й�ϵ�У�һ����ȷ����___��
A.c(H+)��c(OH-)=1��10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
��3����֪������H2A�ĸ���(CaA)�ı�����Һ�д�������ƽ�⣺CaA(s)![]() Ca2+(aq)+A2-(aq) ��H��0����Ҫʹ����Һ��Ca2+Ũ�ȱ�С���ɲ�ȡ�Ĵ�ʩ��___��
Ca2+(aq)+A2-(aq) ��H��0����Ҫʹ����Һ��Ca2+Ũ�ȱ�С���ɲ�ȡ�Ĵ�ʩ��___��
A.�����¶� B.�����¶� C.����NH4Cl���� D.����Na2A����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£�������������Һ��A.0.1mol/LNH4Cl B.0.1mol/L CH3COONH4 C.0.1mol/LNH4HSO4 D.0.1mol/LNH4HCO3 E.0.1mol/LNaHCO3
�����Ҫ����д���пհף�
��1����ҺA��___��(������������������������)����ԭ���ǣ�___(�����ӷ���ʽ��ʾ)��
��2����ҺE��___��(������������������������)����ԭ���ǣ�___(�����ӷ���ʽ��ʾ)��
��3���Ƚ���ҺA��C��c(NH4+)�Ĵ�С��ϵ��A___C(����>������<������=��)��
��4�������£������ҺB��pH=![]() ����CH3COO-��ˮ��̶�___NH4+��ˮ��̶�(����>������<������=��)��CH3COO-��NH4+Ũ�ȵĴ�С��ϵ�ǣ�c(CH3COO-)___c(NH4+)(����>������<������=��)��
����CH3COO-��ˮ��̶�___NH4+��ˮ��̶�(����>������<������=��)��CH3COO-��NH4+Ũ�ȵĴ�С��ϵ�ǣ�c(CH3COO-)___c(NH4+)(����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ϴ�������ֱû��ˮ�У�������ˮ�����������٣�һ��ʱ�����AB�β����϶����⣬BC�θ�ʴ���أ����й��ڴ������˵���������
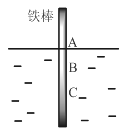
A.����AB�η�����ӦΪO2+ 4e-+ 2H2O = 4OH-
B.��ʴ�������������ϻ�����������ҷ�����AB�ε�BC��
C.��ˮ�м���һ��������ع�����������������ʼ�����Ӱ��
D.������������ı���ԭ�������������Ļ�ѧ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±������KOH����Һ�м��Ȳ�������ȥ��Ӧ���ǣ� ��
��![]() ��
��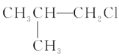 ��(CH3)3CCH2Cl ��CHCl2-CHBr2 ��
��(CH3)3CCH2Cl ��CHCl2-CHBr2 ��![]() ��CH3Cl
��CH3Cl
A.�٢ۢ�B.�ڢۢ�C.ȫ��D.�ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com