
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应条件没有标出)。
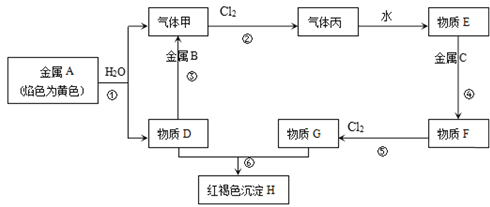
请回答下列问题:
(1)写出下列物质的化学式:B___、丙____;
(2)写出下列反应的离子方程式:
反应③_____;
反应⑤_____;
(3)向F的溶液中加入D溶液后产生的现象是____,用化学反应方程式解释产生此现象的原因____、___。
【答案】Al HCl 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++Cl2=2Fe3++2Clˉ 先变成白色沉淀,然后迅速变成灰绿色,最后变成红褐色沉淀 FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2;判断C为Fe。
(1)依据分析B为Al,E为HCl;
(2)反应③是氢氧化钠和铝反应生成氢气和偏铝酸钠,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑ ;
反应⑤是氯化亚铁和氯气反应生成氯化铁的反应,反应的化学方程式为:2FeCl2+Cl2=2FeCl3,离子方程式为:2Fe2++Cl2=2Fe3++2Clˉ ;
(3)F为FeCl2,D为NaOH,向F溶液中加入D溶液,生成氢氧化亚铁白色沉淀,在空气中被氧化成氢氧化铁,氢整个反应过程的实验现象是先有白色沉淀出现,然后白色沉淀逐渐变为墨绿色最终变为红褐色,涉及的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O═4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】阿明洛芬属于苯丙氨酸类抗炎药。镇痛效果优于布洛芬。如图是阿明洛芬的一条合成路线。
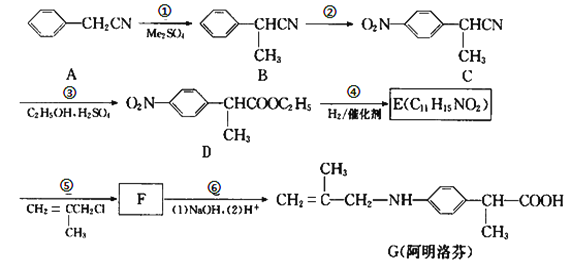
(1)反应①为取代反应,该步反应物Me2SO4中的“Me”表示___,D中官能团的名称是__。
(2)写出E的结构简式___。
(3)写出B到C这步反应的化学方程式___。
(4)G不能发生的反应类型是_____(填字母序号)。
A.水解反应 B.酯化反应 C.还原反应 D.加聚反应 E.缩聚反应
(5)写出F在NaOH溶液中反应的化学方程式_____。
(6)写出所有满足下列条件的B的同分异构体____。
①只含有一个环(即苯环)的芳香族化合物;
②核磁共振氢谱中氢峰的个数相比B的其它同分异构体最少。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)3.4gNH3中含有________molH。
(2)标准状况下,等体积的CO和CO2的质量比为________。
(3)100mLAl2(SO4)3溶液中c(Al3+)=0.20molLˉ1,则c(SO42-)=_______。
(4)物质的量浓度相同的NaCl、MgCl2、AlCl3溶液中分别加入足量的AgNO3溶液中,生成沉淀的质量相等,三种溶液的体积比为____________。
(5)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,则该溶液的溶质的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数由多到少的顺序是( )
①24 g碳 ②0.7 mol NH3 ③4.6 g钠 ④0.2 mol H2SO4 ⑤4 g He
A. ①③②④⑤B. ②①④⑤③
C. ②④①⑤③D. ④⑤②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A. 含有NA个氧原子的氧气在标准状况下的体积约为22.4 L
B. 2 L 0.3 mol·L-1的硫酸钾溶液中钾离子浓度为0.6 mol·L-1
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 0.1 mol Fe在0.1 mol氯气中充分燃烧时转移的电子数为0.3NA
B. 0.1 mol乙烷和丙烯的混合物所含氢原子数目为0.6NA
C. 64 g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 标准状况下,2.24 L四氯化碳含有的分子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数如下表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a. CH3COOH b. H2CO3 c. NaHCO3 d. HClO
pH由小到大的排列顺序是____(填字母)。
(2)常温下,0.1 mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____(填字母)。
A. c(H+) B.![]() C. c(H+)·c(OH-) D.
C. c(H+)·c(OH-) D.![]() E.
E.![]()
(3)体积均为100 mL、pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是____。在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况的体积大小关系为:CH3COOH____(填“大于”、“小于”或“等于”)HX

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为Fe2O3和CuO的混合物且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
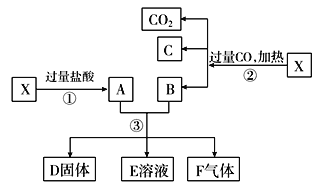
(1)写出步骤③可能发生反应的离子方程式:________________________(共有3个,任写一个即可)。
(2)若溶液E中只有一种金属离子,则一定是__________;若溶液E中含有两种金属离子,则一定是________。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com