
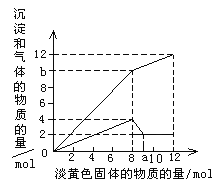
【题目】某溶液中可能含有Fe2+ 、Mg2+、Cu2+、NH4+、Al3+。当加入1 种淡黄色固体并加热时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。
(1)淡黄色固体是__________________________。
(2)可知溶液中一定没有的离子是 ,理由是 。
(3)请解释为什么在投入8mol淡黄色固体后,产生气体的量在减少 。
(4)写出淡黄色固体加入的量为8mol到10mol之间发生的所有离子方程式 。
(5)所含离子的物质的量之比为__________________________。
【答案】(1)Na2O2
(2)Fe2+,Cu2+;只产生白色沉淀,Cu(OH)2是蓝色沉淀,Fe2+被Na2O2氧化为Fe3+,将会产生红褐色沉淀。
(3)8mol之后,NH4+ 被消耗完全,产生的气体只有O2。
(4)2Na2O2+2H2O=4 Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O
(5)1:1:3 (顺序可调换)
【解析】
试题分析:(1)淡黄色固体为Na2O2,故答案为:Na2O2;
(2)淡黄色粉末是过氧化钠,加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,当加入过量的过氧化钠时,生成白色沉淀,Cu(OH)2是蓝色沉淀,Fe2+被Na2O2氧化为Fe3+,将会产生红褐色沉淀。因此无Fe2+, Cu2+,通过图象知,在加入过量的过氧化钠的过程中,沉淀部分溶解,推断一定含有Al3+ 和Mg2+,氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱,最终的白色沉淀的成分是氢氧化镁。溶液中一定没有的离子是Fe2+, Cu2+,理由是只产生白色沉淀,Cu(OH)2是蓝色沉淀,Fe2+被Na2O2氧化为Fe3+,将会产生红褐色沉淀,故答案为:Fe2+, Cu2+;只产生白色沉淀,Cu(OH)2是蓝色沉淀,Fe2+被Na2O2氧化为Fe3+,将会产生红褐色沉淀;
(3)在投入8mol淡黄色固体后,NH4+ 被消耗完全,产生的气体只有O2,产生气体的量逐渐减少,故答案为:NH4+ 被消耗完全,产生的气体只有O2;
(4)过氧化钠的量为8mol到10mol之间发生时过氧化钠与水反应放出氧气,同时生成氢氧化钠,生成的氢氧化钠溶解氢氧化铝,使得沉淀逐渐减少,反应的离子方程式为2Na2O2+2H2O=4 Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O,故答案为:2Na2O2+2H2O=4 Na++4OH-+O2↑,Al(OH)3+OH-=AlO2-+2H2O;
(5)根据a-12mol这一段,所得氢氧化镁的物质的量是2mol,所以含有镁离子其物质的量为2mol,消耗氢氧化钠4mol,即在0-8mol这一段内,共生成沉淀4mol,所以另外2mol是氢氧化铝,即铝离子的物质的量为2mol,12mol过氧化钠放出氧气6mol,根据图像,共生成气体12mol,因此铵离子与氢氧化钠的氢氧根反应生成氨气,生成6mol的氨气,所以含有铵根离子是6mol,Mg2+、Al3+、NH4+的物质的量之比为1:1:3,故答案为:1:1:3。


科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
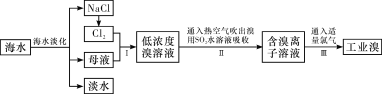
(1)除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
(2)制备钠单质的方法之一是将熔融NaCl进行电解,写出电解化学方程式:
________________________________________________________________________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______________。写出步骤Ⅱ中发生反应的化学方程式:_______________________________________________。
(4)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59 ℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下实验装置:
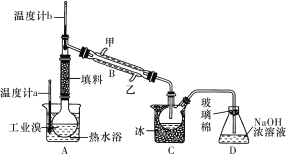
①图中仪器B的名称是________,冷却水的出口为____(填“甲”或“乙”)。
②C中液体的颜色为__________________。
③D装置的作用是__________________。
(5)已知某溶液中Cl-、Br-、I-的物质的量之比为2∶3∶4,现欲使溶液中的Cl-、Br-、I-的物质的量之比变成4∶3∶2,那么要通入Cl2的物质的量是原溶液中I-的物质的量的__________。(填选项)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
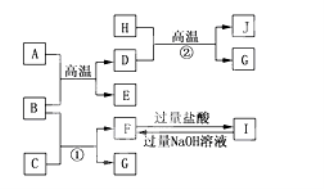
【题目】如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
根据图示回答问题:
(1)写出下列物质的化学式: C ,E ,I ,J 。
(2)反应①的离子方程式是_____________________;反应②的化学方程式是________________________;
(3)F与I反应的离子方程式是__________________;
(4)向一定体积的稀硫酸中加入少量的J固体,反应后的溶液与NaClO发生氧化还原反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列FeCl3的性质中,能够证明FeCl3是共价化合物的是( )
A.FeCl3易溶于水
B.液态的FeCl3不导电
C.FeCl3常温下不易分解
D.FeCl3溶于水能电离,呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的描述和相关知识均正确的是( )
物质及变化 | 描述 | 相关知识 | |
A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛”。下列关于“强水”的判断错误的是( )
A.“强水”可能是重水
B.“强水”可能是硝酸
C.“强水”可能具有强氧化性、强酸性
D.“强水”不可能是氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为 。
(2)由A、B、W三种元素组成的18电子微粒的电子式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路反上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氯化物DA,熔点为800℃DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是__ (标准状况下)。
(6)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.NH3的喷泉实验说明氨气极易溶于水
B.NO 和NH3均可用排空气法收集
C.盛液溴的瓶内加少量水可防止液溴的挥发
D.NH3遇到挥发性的强酸能冒白烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com