
【题目】下列化合物中,同分异构体数目超过7的有(包括自己) ( )
A.丁醇 B.乙酸乙酯 C.1,2-二溴丙烷 D.戊烷
科目:高中化学 来源: 题型:
【题目】硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将淀粉与KCl的混合液装在半透膜中,浸泡在装有蒸馏水的烧杯中,过一段时间后,取烧杯中液体进行实验,能证明半透膜有破损的是
A.加入碘水不变色 B.加入AgNO3 溶液产生白色沉淀
C.加入AgNO3 溶液不产生白色沉淀 D.加入碘水变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Fe2+ 、Mg2+、Cu2+、NH4+、Al3+。当加入1 种淡黄色固体并加热时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示。
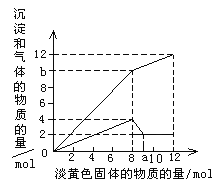
(1)淡黄色固体是__________________________。
(2)可知溶液中一定没有的离子是 ,理由是 。
(3)请解释为什么在投入8mol淡黄色固体后,产生气体的量在减少 。
(4)写出淡黄色固体加入的量为8mol到10mol之间发生的所有离子方程式 。
(5)所含离子的物质的量之比为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑧是几种有机物的名称、分子式或结构简式:
①C2H4 ②环己烯 ③苯 ④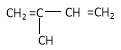 ⑤
⑤![]()
⑥CH3CH(C2H5)CH2CH(C2H5)CH3 ⑦C5H10 ⑧ClCH = CHCl
据此回答下列问题:
(1)实验室制①的化学方程式为____________。
(2)③的同系物A,分子中共含74个电子,且A不能被酸性高锰酸钾溶液氧化为芳香酸, 则其结构简式是____________。
(3)⑥的系统命名法为____________。
(4)若⑦为一种链烃,则与⑦互为同系物的是____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢(H2S)的转化是资源利用和环境保护的重要研究课题。
(1)H2S和CO混合加热可制得羰基硫(COS)。羰基硫可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。反应方程式为:
CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
①羰基硫的电子式为_________其含有的共价键类型是________共价键。
②下列能说明碳与硫两元素非金属性相对强弱的是_____________。
a.相同条件下水溶液的pH:Na2CO3 > Na2SO4
b.酸性:H2SO3 > H2CO3
c.S与H2的化合比C与H2的化合更容易
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式__________________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
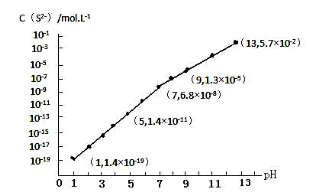
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
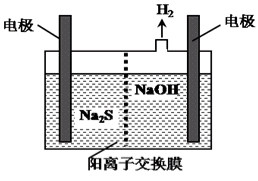
S2--2e-=S↓ (n-1)S+S2-![]() Sn2-
Sn2-
①写出电解时阴极的电极反应式:______________________。
②Na2S溶液中离子浓度由大到小顺序:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如下表所示:
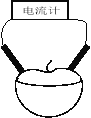
已知:西红柿、苹果果汁都是显酸性。
实验编号 | 水果种类 | 电极间距离/㎝ | 电流大小/A |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹 果 | 2 | 27.2 |
(1)该实验的目的是探究水果种类和________对水果电池电流大小的影响。
(2)能表明水果种类对电流大小有影响的实验编号是 和 。
(3)上图所示的装置中,负极的电极反应式为 ,正极附近区域c(H+)将 (填“增大”、“减小”、“不变”),总反应离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com