
【题目】某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如下表所示:
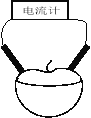
已知:西红柿、苹果果汁都是显酸性。
实验编号 | 水果种类 | 电极间距离/㎝ | 电流大小/A |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹 果 | 2 | 27.2 |
(1)该实验的目的是探究水果种类和________对水果电池电流大小的影响。
(2)能表明水果种类对电流大小有影响的实验编号是 和 。
(3)上图所示的装置中,负极的电极反应式为 ,正极附近区域c(H+)将 (填“增大”、“减小”、“不变”),总反应离子方程式为 。
【答案】(1)电极间距离
(2)②;③
(3)Zn-2e-=Zn2+;减小;Zn+2H+=Zn2++H2↑
【解析】
试题分析:(1)①②中电极间距离不同,②③中水果种类不同,电极间距离、水果种类都导致其电流不同,所以该实验的目的是探究水果种类和电极间距对水果电池电流大小的影响。
故答案为:电极间距;
(2)②③中水果种类不同导致其电流不同,所以能表明水果种类对电流大小有影响的实验编号是②和③。
故答案为:②;③;
(3)该装置中,Zn易失电子作负极、电极反应式为:Zn-2e-=Zn2+;Cu作正极,电极反应式为:Zn+2H+=Zn2++H2↑,所以正极区c(H+)将减小。该电池总反应离子方程式为:Zn+2H+=Zn2++H2↑。
故答案为:Zn-2e-=Zn2+;减小;Zn+2H+=Zn2++H2↑。


科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系不正确的是
A. 热稳定性:HCl>HI
B. O2和O3互为同素异形体
C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3
D. 干冰和冰为同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.NH3的喷泉实验说明氨气极易溶于水
B.NO 和NH3均可用排空气法收集
C.盛液溴的瓶内加少量水可防止液溴的挥发
D.NH3遇到挥发性的强酸能冒白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验,请回答下列问题:

(1)装置甲中盛放浓硝酸的仪器A的名称是 ,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白
装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
乙 | 淡黄色固体变白色 | Na2O2+2NO2=2NaNO3 | |
丙 | 氧化性 |
(3)取下装置丙中的试管C,向其中滴加足量的Na2SO3溶液,溶液颜色褪去,该过程中发生反应的离子方程式为 。
反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol/LHCl、1mol/LH2SO4、1mol/LBaCl2、1mol/LBa(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。
编号 | 实验操作 | 预期现象和结论 |
步骤1 | 取少量待测液于试管A中,加入几滴新制得饱和溴水,振荡 | ,证明待测液中含有SO32— |
步骤2 | ||
步骤3 | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡、静置后观察颜色 | ,证明待测液中含有I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.CO具有还原性,可用于冶炼铁等金属
C.SiO2熔点高,可用作光导纤维
D.Al2O3具有两性,可用作耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应的认识正确的是
A.化学反应过程中,一定有化学键的断裂和形成
B.日常生活中的废旧电池会污染环境,所以应集中填埋处理
C.化学反应过程中,分子的种类和数目一定发生改变
D.放热反应的反应速率,一定比吸热反应的反应速率快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题
Ⅰ.实验室从含碘废液(除H2O外,还含有CCl4、I2、I-等)中回收碘,其实验过程如下:
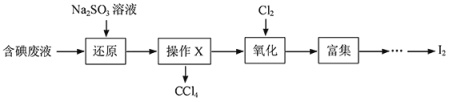
(1)Na2SO3溶液在空气中存放,容易被氧化成 (填化学式)。
检验是否存在该杂质的方法是: 。
(2)操作X的名称为 。
(3)通入Cl2发生反应的离子方程式 。
(4)含碘废液中加入稍过量的Na2SO3溶液,Na2SO3将废液中的I2还原为I-,这样做的目的是 。
Ⅱ.亚硫酸钠溶液中加入过量的碘酸钾酸性溶液,反应的化学方程式为(未配平):
Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O。回答下列问题:
(1)若反应中有5 mole- 转移,则生成碘是 mol。
(2)该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+SO32-→IO―+SO42-(快)
③IO―+SO32-→I―+SO42-(快)
④5I―+6H++IO3-→3I2+3H2O(快)
⑤I2+SO32-+H2O→2I-+SO42-+2H2(快)
由上述条件推测,此反应的总的反应速率由第 步反应决定(填序号)。
(3)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,蓝色现象才会产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏四氯乙烷是一种常见化工原料,以偏四氯乙烷和烯烃(C5H10)为原料合成某种六元环酯(C7H10O4)的合成路线如下:
已知:一个碳原子上连接2个—OH不稳定,容易脱水变成![]()

(1)化合物II中能与能与金属钠反应的官能团名称为 。
(2)化合物IV合成化合物V的反应类型为 ,化合物V合成化合物VI反应类型为 。
(3)写出由化合物VI合成化合物VII的反应方程式 。
(4)有机物R是化合物IV的同分异构体,R能使溴水褪色,且其核磁共振氢谱中有4组峰,有机物R的结构简式为 ,该六元环酯(C7H10O4)的结构简式为 。
(5)参照上合成路线,设计以有机物(![]() )和乙二醇为原料合成聚乙二酸乙二醇酯的合成路线。
)和乙二醇为原料合成聚乙二酸乙二醇酯的合成路线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com