
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验,请回答下列问题:

(1)装置甲中盛放浓硝酸的仪器A的名称是 ,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白
装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
乙 | 淡黄色固体变白色 | Na2O2+2NO2=2NaNO3 | |
丙 | 氧化性 |
(3)取下装置丙中的试管C,向其中滴加足量的Na2SO3溶液,溶液颜色褪去,该过程中发生反应的离子方程式为 。
反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol/LHCl、1mol/LH2SO4、1mol/LBaCl2、1mol/LBa(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。
编号 | 实验操作 | 预期现象和结论 |
步骤1 | 取少量待测液于试管A中,加入几滴新制得饱和溴水,振荡 | ,证明待测液中含有SO32— |
步骤2 | ||
步骤3 | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡、静置后观察颜色 | ,证明待测液中含有I- |
【答案】(1)分液漏斗;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(2)
装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
乙 | 还原性 | ||
丙 | 溶液变蓝色 | NO2+2KI+H2SO4 =K2SO4 +I2 +NO+H2O |
(3)I2+SO32-+H2O=2I-+SO42-+2H+
编号 | 实验操作 | 预期现象和结论 |
步骤① | 溴水褪色 | |
步骤② | 另取少量待测液于试管B中,加入过量的2 mol/L的盐酸,再滴加适量1 mol/L的 BaCl2 溶液 | 产生白色沉淀,证明含有SO42- |
步骤③ | 溶液分层,下层液体呈紫色 |
【解析】
试题分析:(1)装置甲中盛放浓硝酸的仪器A的名称是分液漏斗;烧瓶中发生浓硝酸与铜片的氧化还原反应,写出化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
故答案为:分液漏斗、Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
(2)Na2O2+2NO2═2NaNO3反应中,NO2中N元素化合价升高,发生氧化反应,显示还原性;NO2表现
的化学性质为氧化性,则NO2中N元素化合价降低,装置丙的反应为:NO2+2KI+H2SO4═K2SO4+I2+NO+H2O,NO2将试管中的KI氧化为I2,与淀粉显蓝色。
故答案为:
装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
乙 | 还原性 | ||
丙 | 溶液变蓝色 | NO2+2KI+H2SO4═K2SO4+I2+NO+H2O |
(3)装置丙中,NO2将试管中的KI氧化为I2,与淀粉显示蓝色,当加入Na2SO3溶液后,I2被Na2SO3
还原为I-,颜色褪去,化学方程式为:I2+SO32-+H2O═2I-+SO42-+2H+。
故答案为:I2+SO32-+H2O═2I-+SO42-+2H+;
步骤①为了证明证明待测液中含有SO32-,则可加入氧化性试剂,且有明显现象的试剂;
步骤③根据实验操作可知为检验I-,加入足量氯水,再加入四氯化碳,静置后观察颜色,若实验现象为:溶液分层,下层液体呈紫红色,证明待测液含有I-;
步骤②为鉴定SO42-,SO42-检验方式加入过量的2 molL-1的盐酸,再滴加适量1 molL-1的 BaCl2溶液,实验现象为含有白色沉淀。
故答案为:
编号 | 实验操作 | 预期现象和结论 |
步骤① | 新制饱和溴水 | 溴水褪色 |
步骤② | 另取少量待测液于试管B中,加入过量的2 molL-1的 盐酸,再滴加适量1 molL-1的 BaCl2溶液 | 产生白色沉淀,证明含有SO42- |
步骤③ | 溶液分层,下层液体呈紫红色 |


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
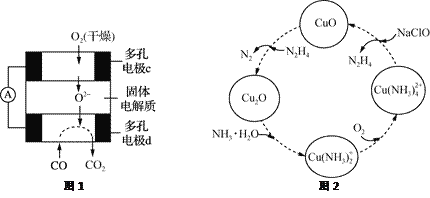
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________
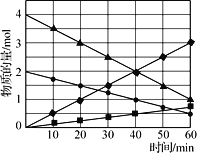
图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。
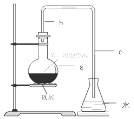
(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起__________的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有__________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有__________色不溶于水的液体。这是溶解了__________的粗溴苯。
(5)写出烧瓶a中发生反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红色溶液X中通入气体Y,溶液逐渐褪色,下列对X、Y的推断正确的是( )
A.若X为品红溶液,则Y一定是Cl2或SO2
B.若X为含酚酞的氢氧化钠溶液,则Y可能是SO2
C.若X为含KSCN的氯化铁溶液,则Y一定是HI
D.若X为含硫酸氢钠的石蕊溶液,则Y可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池(如图所示),得到的实验数据如下表所示:
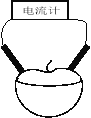
已知:西红柿、苹果果汁都是显酸性。
实验编号 | 水果种类 | 电极间距离/㎝ | 电流大小/A |
① | 西红柿 | 1 | 98.7 |
② | 西红柿 | 2 | 72.5 |
③ | 苹 果 | 2 | 27.2 |
(1)该实验的目的是探究水果种类和________对水果电池电流大小的影响。
(2)能表明水果种类对电流大小有影响的实验编号是 和 。
(3)上图所示的装置中,负极的电极反应式为 ,正极附近区域c(H+)将 (填“增大”、“减小”、“不变”),总反应离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.任何条件下,16gCH4与18 g H2O所含有电子数均为10NA
B.19g的H3O+ 离子中含有的电子数为11NA
C.0.5mol/LH2SO4中的H+数为NA
D.22.4 L的CO气体与1 mol N2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | CO(g) | CO2(g) | NaOH溶液、浓H2SO4 | 洗气 |
B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
D | Na2CO3(s) | NaHCO3(s) | —— | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有下列六种离子:①HCO3- ②SO32- ③Na+ ④CO32- ⑤NH4+ ⑥NO3-,向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是( )
A.只有⑥ B.④⑥ C.③④⑥ D.①②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com