
���� ��I�� 2SO2+O2?2SO3��
��ʼ��mol��1 1 0
��Ӧ��mol��0.6 0.3 0.6
3min��mol��0.4 0.7 0.6
c��O2��=$\frac{��n}{V}$��v��SO2��=$\frac{\frac{��n}{V}}{��t}$��
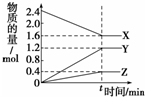
��II����1�����ŷ�Ӧ�Ľ��У�X�����ʵ������٣�Y��Z�����ʵ������ӣ���X�Ƿ�Ӧ�Y��Z��������ﵽƽ��ʱ��n��X��=��2.4-1.6��mol=0.8mol����n��Y��=��1.2-0��mol=1.2mol����n��Z��=��0.4-0��mol=0.4mol��ͬһ���淴Ӧ�У�ͬһ��ʱ���ڣ��μӷ�Ӧ�ĸ����ʵ����ʵ����仯��֮�ȵ����������֮�ȣ�
��2��v��Y��=$\frac{\frac{��n}{V}}{��t}$��
��3����Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ���ڶ�̬ƽ��״̬����Ӧ��ϵ�и����ʵ����ʵ������䣮
��� �⣺��I�� 2SO2+O2?2SO3��
��ʼ��mol��1 1 0
��Ӧ��mol��0.6 0.3 0.6
3min��mol��0.4 0.7 0.6
c��O2��=$\frac{��n}{V}$=$\frac{0.3mol}{2L}$=0.15mol/L��v��SO2��=$\frac{\frac{��n}{V}}{��t}$=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/��L��min����
�ʴ�Ϊ��0.15mol/L��0.1mol/��L��min����
��II����1�����ŷ�Ӧ�Ľ��У�X�����ʵ������٣�Y��Z�����ʵ������ӣ���X�Ƿ�Ӧ�Y��Z��������ﵽƽ��ʱ��n��X��=��2.4-1.6��mol=0.8mol����n��Y��=��1.2-0��mol=1.2mol����n��Z��=��0.4-0��mol=0.4mol��ͬһ���淴Ӧ�У�ͬһ��ʱ���ڣ��μӷ�Ӧ�ĸ����ʵ����ʵ����仯��֮�ȵ����������֮�ȣ���X��Y��Z�ļ�����֮��=0.8mol��1.2mol��0.4mol=2��3��1����÷�Ӧ����ʽΪ2X?3Y+Z��
�ʴ�Ϊ��2X?3Y+Z��
��2��v��Y��=$\frac{\frac{��n}{V}}{��t}$=$\frac{\frac{1.2mol}{2L}}{10min}$=0.02mol/��L��min�����ʴ�Ϊ��0.02mol/��L��min����
��3��A������tʱ�̣����淴Ӧ������ȣ���Ӧ���ڶ�̬ƽ��״̬����A����
B����tʱ��֮ǰƽ�������ƶ�����X���������ʴ��������������ʣ���B��ȷ��
C����tʱ�̷�Ӧ����ƽ��״̬������Ӧ���ʵ����淴Ӧ���ʣ���C��ȷ��
D����tʱ�̴ﵽƽ�������淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ������䣬����Ӧ������ʵ�����һ������������������ʵ������뷴Ӧ��ʼ���ʵ�����ת�����йأ���D����
��ѡBC��
���� ���⿼�黯ѧƽ����㼰��ѧƽ��״̬�жϣ�Ϊ��Ƶ���㣬���ؿ���ѧ�������жϼ�������������ȷƽ��״̬��������ѧƽ������еġ�����ʽ���ǽⱾ��ؼ�����Ŀ�ѶȲ���


 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | FeCl3�TFe3++Cl3- | B�� | NaHCO3�TNa++H++CO32- | ||
| C�� | Al2��SO4��3�T2Al3++3SO42- | D�� | KMnO4�TK++Mn7++4O2- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ | B�� | ͨHCl���� | C�� | ��NaOH���� | D�� | ��MgSO4 ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� ת���� ѹǿ | 500K | 600K |
| P | 60% | b |
| 1.5P | a | 55% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
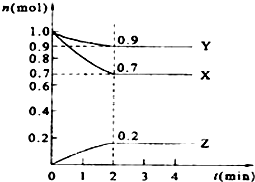 ij�¶�ʱ����2L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ��
ij�¶�ʱ����2L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��������һ����Ҫ���л�����ԭ�ϣ���е�Ϊ38.4�森�Ʊ��������һ�ַ������Ҵ��������ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽ��CH3CH2OH+HBr$��_{��}^{Ũ����}$CH3CH2Br+H2O��
��������һ����Ҫ���л�����ԭ�ϣ���е�Ϊ38.4�森�Ʊ��������һ�ַ������Ҵ��������ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽ��CH3CH2OH+HBr$��_{��}^{Ũ����}$CH3CH2Br+H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10g H2 | B�� | 2molCl2 | C�� | 1.5NACO2 | D�� | 22.4LO2����״���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com