
【题目】某学生在如图所示的装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题。
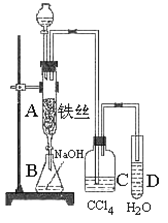
(1)写出A中发生的有机反应的化学方程式_____________________;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是____________,然后用_______________仪器分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管D中滴加AgNO3溶液有_______(填现象)生成,此现象说明这种获得溴苯的反应属于________反应(填有机反应类型)
科目:高中化学 来源: 题型:
【题目】氧化铝在工业上有着广泛的应用。(写出计算过程)
(1)制取净水剂氯化铝。其原理为:Al2O3+3C+3Cl2![]() 2AlCl3+3CO。25.5g 氧化铝、3.6g 碳、4.48L(标准状态)氯气混合后在高温下反应,理论上可得氯化铝_____克。
2AlCl3+3CO。25.5g 氧化铝、3.6g 碳、4.48L(标准状态)氯气混合后在高温下反应,理论上可得氯化铝_____克。
(2)向100g氢氧化钠溶液中加入10g 氧化铝,充分反应后,剩余固体4.9克。测得所得溶液的密度为1.051g/cm3 。则所得溶液的物质的量浓度为______________。
(3)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C![]() 2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
① 取一定量样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭__________g。
② 向①中反应后的容器中加入过量的NaOH浓溶液共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,得到氨气3.36L(标准状况)及16.38g的固体。再将该固体配成溶液,向其中慢慢加入1mol/L盐酸,当加到20mL时开始产生沉淀。求该样品中的AlN的质量分数为________。(用小数表示,保留2位小数)
(4)用氧化铝为原料可制得含铝化合物X。取6.9gX放入100mL水中完全溶解,溶液呈弱酸性。取出10mL加入过量盐酸,无气泡,再加入过量氯化钡有白色沉淀0.932g 。另取10mL样品,慢慢滴加氢氧化钠溶液直至过量,过程中出现的现象为出现白色沉淀→沉淀逐渐增多→沉淀不再变化→沉淀开始减少→沉淀全部消失。若改用氨水做上述实验最终可得0.156g沉淀。经测定X中含氢量为4.64% 。求化合物X的化学式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应速率的说法中,不正确的是( )
A.反应速率用于衡量化学反应进行的快慢
B.决定反应速率的主要因素有浓度、压强、温度和催化剂
C.可逆反应达到化学平衡时,正、逆反应的速率都不为0
D.增大反应物浓度、提高反应温度都能增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醇、乙酸的说法中,不正确的是
A. 乙醇不能与金属钠反应
B. 乙醇在空气中燃烧时放出大量的热
C. 乙酸能与CaCO3反应放出CO2
D. 在浓硫酸存在下,加热,乙酸与乙醇发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为_________
(2)已知:2Mo(s)+3O2(g)==2MoO3(s)△H1 ;
2MoS2(s)+ 7O2(g)= 2MoO3(s)+4SO2(g)△H2 ;
MoS2(s)+2O2(g)=Mo(s)+2SO2 (g)△H3
则△H3=_______(用含△Hl、△H2的代数式表示)。
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-。
① 辉钼矿应放入电解槽的__________(填“阴极区”或“阳极区”)。
② 阴极的电极反应式为______________。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoOS2(s)+4H2(g) +2Na2CO3(s)![]() MO(s)+2CO(g)+4H2O(g)+2Na2S(s)△H,实验测得平衡时的有关变化曲线如图所示。
MO(s)+2CO(g)+4H2O(g)+2Na2S(s)△H,实验测得平衡时的有关变化曲线如图所示。
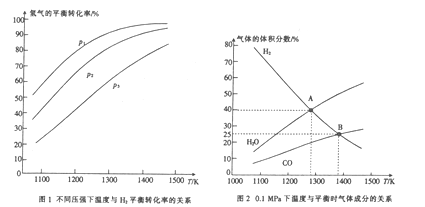
① 由图l可知,该反应△H___(填“>”或“<”)0,p1、p2、p3由大到小的顺序为____。
② 由图2可知,A点时H2的平衡转化率为____。
③ B点对应的平衡常数K=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用稀NaOH溶液与稀盐酸反应测定中和热的实验中,下列操作错误的是
A. 反应前酸、碱溶液的温度要相同
B. 测量混合溶液温度时,温度计插在溶液中
C. 为了使反应均匀进行,可以向酸中分多次加入碱
D. 为了使反应更完全,可以使碱适当过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按官能团的不同,可以对有机物进行分类,现有以下有机物:
A. CH3CH2CH2COOH
B.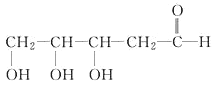
C.![]()
D.![]()
E.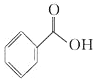
F. ![]()
G. 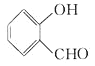
(1)其中,可看做酚类的是___________(填写字母,下同);可看做醇类的是___________;可看做酯类的是___________;属于苯的同系物的是____________。
(2)分别写出物质E和F中所含官能团的名称____________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LCCl4所含分子数约为NA个
B.标准状况下,22.4L乙醇中含有的氧原子数目为NA
C.lmolNaHCO3晶体中含有阳离子数目为2NA
D.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,B、C、D的原子序数依次递增。A原子核内有一个质子,B原子的电子总数与D原子最外层电子数相等,D原子最外层电子数是其电子层数的3倍,E原子的L层电子数小于K、M层电子数之和,由此推断:
(1)A与D组成的化合物中,含有非极性键的分子的电子式为________;B与D组成的三原子分子的结构式为__________;A与C组成的化合物分子的电子式为______________。
(2) C、D、E离子半径由大到小的顺序是______________________(填化学符号)
(3)E元素最高价氧化物对应水化物与氢氧化铝反应的离子方程式为__________________。
(4)已知A、B、C、D可组成一种化合物,其原子个数比为8︰1︰2︰3,该化合物的化学式为__________,属__________(离子、共价)化合物。
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com