
【题目】氧化铝在工业上有着广泛的应用。(写出计算过程)
(1)制取净水剂氯化铝。其原理为:Al2O3+3C+3Cl2![]() 2AlCl3+3CO。25.5g 氧化铝、3.6g 碳、4.48L(标准状态)氯气混合后在高温下反应,理论上可得氯化铝_____克。
2AlCl3+3CO。25.5g 氧化铝、3.6g 碳、4.48L(标准状态)氯气混合后在高温下反应,理论上可得氯化铝_____克。
(2)向100g氢氧化钠溶液中加入10g 氧化铝,充分反应后,剩余固体4.9克。测得所得溶液的密度为1.051g/cm3 。则所得溶液的物质的量浓度为______________。
(3)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C![]() 2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
2AlN+3CO。由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。
① 取一定量样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭__________g。
② 向①中反应后的容器中加入过量的NaOH浓溶液共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,得到氨气3.36L(标准状况)及16.38g的固体。再将该固体配成溶液,向其中慢慢加入1mol/L盐酸,当加到20mL时开始产生沉淀。求该样品中的AlN的质量分数为________。(用小数表示,保留2位小数)
(4)用氧化铝为原料可制得含铝化合物X。取6.9gX放入100mL水中完全溶解,溶液呈弱酸性。取出10mL加入过量盐酸,无气泡,再加入过量氯化钡有白色沉淀0.932g 。另取10mL样品,慢慢滴加氢氧化钠溶液直至过量,过程中出现的现象为出现白色沉淀→沉淀逐渐增多→沉淀不再变化→沉淀开始减少→沉淀全部消失。若改用氨水做上述实验最终可得0.156g沉淀。经测定X中含氢量为4.64% 。求化合物X的化学式_______。
【答案】 17.8g 1mol/L 1.92g 0.61 (60.83%亦可) NH4Al(SO4)2·6H2O
【解析】(1)25.5g 氧化铝为25.5g÷102g/mol=0.25mol,3.6g 碳为3.6g÷12g/mol=0.3mol,4.48L(标准状态)氯气为4.48L÷22.4mol/L=0.2mol,若0.2mol完全反应,则:
Al2O3+3C+3Cl2![]() 2AlCl3+3CO
2AlCl3+3CO
0.067mol 0.2mol 0.2mol
氯气不足,故生成氯化铝为0.2mol×2/3×133.5g/mol=17.8g;
(2)氧化铝有剩余,说明氢氧化钠完全反应,参加反应的氧化铝为10g-4.9g=5.1g,溶液质量为100g+5.1g=105.1g,根据Al原子守恒,NaAlO2物质的量=5.1g/102g/mol×2=0.1mol,溶液体积V=105.1g/1051g/L=0.1L,所得溶液物质的量浓度为0.1mol/0.1L
=1mol/L;
(3)① 气体产物的平均摩尔质量=1.34gL-1×22.4L/mol=30g/mol,氧气不足,生成气体是CO和CO2混合气体,CO与CO2的物质的量之比为(44-30):(30-28)=7:1,氧气的物质的量为2.016L/22.4L/mol=0.09mol,设CO2为y mol,由氧原子守恒:7y+2y=0.09×2,解得x=0.02,故碳元素质量为(0.02mol+0.02mol×7)×12g/mol=1.92g;②生成氨气物质的量为3.36L÷22.4L/mol=0.15mol,根据N原子守恒,生成AlN的物质的量为0.15mol,质量为0.15mol×41g/mol=6.15g、消耗盐酸是0.02mol,则氢氧化钠是0.02mol×40g/mol=0.8g,所以偏铝酸钠的质量是16.38g-0.8g=15.58g,物质的量是15.58g÷82g/mol=0.19mol,因此原样品中氧化铝是![]() ,该样品中的AlN的质量分数为
,该样品中的AlN的质量分数为![]() ;(4)取出10mL溶液,加入过量盐酸,无气泡,再加入过量氯化钡有白色沉淀0.932g,说明含有SO42-,则n(SO42-)=n(BaSO4)=0.932g÷233g/mol=0.004mol;另取10mL样品,用慢慢滴加氨水至过量,最多可得到0.156g沉淀,沉淀为Al(OH)3,n(Al3+)=n[Al(OH)3]=0.156g÷78g/mol=0.002mol,若改用氢氧化钠溶液直至过量,可收集到44.8mL的气体(标准状况),说明含有NH4+,则n(NH4+)=n(NH3)=0.0448L÷22.4L/mol=0.002mol,10mL溶液中NH4+、Al3+、SO42-的总质量为0.004mol×96g/mol+0.002mol×27g/mol+0.002mol×18g/mol=0.474g<6.9g/10
;(4)取出10mL溶液,加入过量盐酸,无气泡,再加入过量氯化钡有白色沉淀0.932g,说明含有SO42-,则n(SO42-)=n(BaSO4)=0.932g÷233g/mol=0.004mol;另取10mL样品,用慢慢滴加氨水至过量,最多可得到0.156g沉淀,沉淀为Al(OH)3,n(Al3+)=n[Al(OH)3]=0.156g÷78g/mol=0.002mol,若改用氢氧化钠溶液直至过量,可收集到44.8mL的气体(标准状况),说明含有NH4+,则n(NH4+)=n(NH3)=0.0448L÷22.4L/mol=0.002mol,10mL溶液中NH4+、Al3+、SO42-的总质量为0.004mol×96g/mol+0.002mol×27g/mol+0.002mol×18g/mol=0.474g<6.9g/10
=0.69g,故还含有结晶水,含有结晶水的物质的量为(0.69g0.474g)/18g/mol=0.012mol,
则n(NH4+):n(Al3+):n(SO42-):n(H2O)=0.002:0.002:0.004:0.12=1:1:2:6,故化合物X的化学式为:NH4Al(SO4)2·6H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是
A. 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B. 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快
C. 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D. 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠与水反应的改进实验操作如下:取一张滤纸,用酚酞试液浸润并晾干,裁剪并折叠成信封状,滤纸内放一小块(约绿豆粒般大小)金属钠,把含钠的滤纸信封放入水中,装置如下图所示。
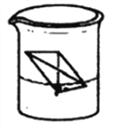
请回答:
(1)写出金属钠与水反应的离子方程式________________。
(2)实验过程中取用金属钠的操作方法是________________。
(3)有关此实验的说法正确的是________________。
A.实验过程中,可能听到爆鸣声
B.实验过程中,看到滤纸信封由白色逐渐变红色
C.实验改进的优点之一是由实验现象能直接得出反应产物
D.实验过程中,多余的金属钠不能放回原试剂瓶中,以免对瓶内试剂产生污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以环氧乙烷和布洛芬为主要原料,按下列路线合成药物布洛芬酰甘氨酸钠。
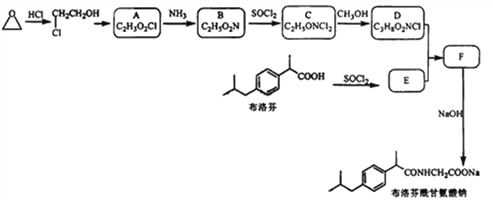
己知:(1)RCOOH ![]() RCOC1
RCOC1 ![]() RCOORˊ
RCOORˊ
(2)R-Cl- ![]() R-NH2
R-NH2 ![]() R-NH2HC1
R-NH2HC1 ![]() RCONHR
RCONHR
请回答:
(1)写出化合物的结构简式:B_________ ; D_________ 。
(2)下列说法不正确的是_________。
A.![]() 转化为A为氧化反应
转化为A为氧化反应
B. RCOOH与SOCl2反应的产物有SO2和HC1
C.化合物B能发生缩聚反应
D.布洛芬酰甘氨酸钠的分子式为C15H19NO3Na
(3)写出同时符合下列条件的布洛芬的所有同分异构体_________。
①红外光谱表明分子中含有酯基,实验发现能与NaOH溶液1∶2反应,也能发生银镜反应;
②H—NMR谱显示分子中有三个相同甲基,且苯环上只有一种化学环境的氢原子。
(4)写出F→布洛芬酰甘氨酸钠的化学方程式_________。
(5)利用题给信息,设计以![]() 为原料制备(
为原料制备(![]() )的合成路线(用流程图表示:无机试剂任选)_____________________。
)的合成路线(用流程图表示:无机试剂任选)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
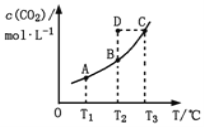
A. 反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的 ΔH>0
CO2(g)+H2(g)的 ΔH>0
B. 在T2时,若反应处于状态D,则一定有ν正<ν逆
C. 平衡状态A与C相比,平衡状态A的c(CO)小
D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期目的是
A. 检验C2H5Cl中的氯元素:将C2H5Cl和NaOH溶液混合加热后,加过量稀HNO3酸化后,再加硝酸银溶液
B. 混有乙酸、乙醇杂质的乙酸乙酯用饱和Na2CO3溶液进行除杂提纯
C. 用碘酒验证汽油是否为裂化汽油
D. 用溴水除去己烷中的己烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )

A. 原子半径:X<Y<Z B. 气态氢化物的稳定性:X>Z
C. Z、W均可与Mg形成离子化合物 D. 最高价氧化物对应水化物的酸性:Y>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是重要的化工原料,以下是某酮酸E的合成路线。
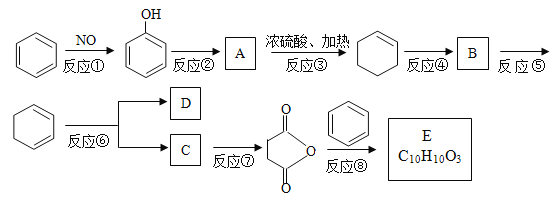
已知:
CH3CH=CHCH3能被氧化成乙酸;
②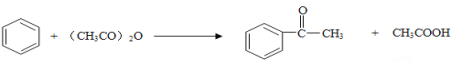
(1)以上合成路线中,属于氧化反应的有:反应⑥和反应________(填反应编号);反应⑤的反应条件是_________________________。
(2)写出结构简式A_______________________;B______________________。
(3)已知C的分子式为C4H6O4,则D的结构简式为______________________;分离C和D的方法是______________。
(4)不能由![]() 直接制取
直接制取![]() ,原因是_____________________________________。
,原因是_____________________________________。
(5)写出反应⑧的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在如图所示的装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题。
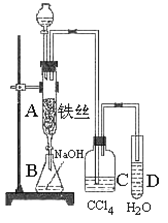
(1)写出A中发生的有机反应的化学方程式_____________________;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是____________,然后用_______________仪器分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管D中滴加AgNO3溶液有_______(填现象)生成,此现象说明这种获得溴苯的反应属于________反应(填有机反应类型)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com