
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
 2H++S
2H++S科目:高中化学 来源: 题型:单选题
关于室温下下列溶液的说法不正确的是
| A.水的电离程度:①=②=③=④ |
| B.分别加水稀释10倍,溶液的pH:①>②>③>④ |
C.①、③两溶液等体积混合: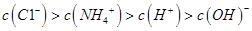 |
D.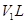 溶液②与 溶液②与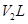 溶液③混合,若 溶液③混合,若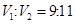 ,则混合溶液pH=4(忽略溶液体积变化) ,则混合溶液pH=4(忽略溶液体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是( )
| A.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
| B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| C.常温下,向NH4Cl溶液中加入氨水至溶液的pH=7,此时溶液中c(NH4+)>c(C1-) |
| D.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则下列关于同温、同体积、同浓度的HCN和HClO溶液的说法中正确的是( )
| A.酸的强弱:HCN>HClO |
| B.pH:HClO>HCN |
| C.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
| D.酸根离子浓度:c(CN-)<c(ClO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol·L-1 NaHSO3溶液中,下列关系正确的是( )
| A.c(HSO3-)>c(SO32-)>c(H2SO3) |
| B.c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C.c(Na+)=c(HSO3-)>c(H+)>c(OH-) |
| D.c(Na+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25 ℃时KW=10-14,如果100 ℃时KW=5.5×10-13,这说明( )
| A.100 ℃时水的电离程度较小 |
| B.前者c(H+)较后者大 |
| C.水的电离过程是一个吸热过程 |
| D.100 ℃时0.1 mol·L-1 DCl的重水溶液中水的电离程度一定是室温时电离程度的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于电离常数的说法正确的是( )
| A.电离常数随着弱电解质的浓度增大而增大 |
| B.CH3COOH的电离常数表达式为Ka= |
| C.CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 |
| D.电离常数只与温度有关,与浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中微粒浓度关系一定正确的是( )
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加等浓度等体积的NaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于常温下pH均为4的三种溶液:①盐酸,②CH3COOH溶液,③NH4Cl溶液,下列说法中正确的是( )
| A.溶液中由水电离出的c(H+):②>③ |
| B.稀释100倍后溶液的pH:①<③ |
| C.中和相同体积的上述溶液消耗NaOH溶液的体积:①<② |
| D.②和③等体积混合后的溶液:c(CH3COO-)+c(Cl-)=c(NH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com