
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6kJ/mol,CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-a kJ/mol,则a__238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:____。
(3)反应mA(g)+nB(g)![]() pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g)+qD(g)过程中的能量变化如图所示,回答下列问题。
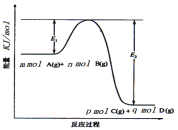
该反应ΔH=___(用含E1、E2式子表示);在反应体系中加入催化剂,E1__,E2__,(填增大、减小、不变)。
【答案】< 2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ/mol ΔH=-(E2-E1)kJ/mol 减小 减小
【解析】
(1)CH3OH(l)的燃烧热是1mol甲醇燃烧生成CO2(g)和H2O(l)放出的热。
(2)1mol Cl2参与反应时释放出145kJ热量,则2mol Cl2与2mol H2O(g)反应放热290 kJ;
(3)焓变=反应物的总键能-生成物的总键能;催化剂降低活化能;
(1)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,液态水为稳定的氧化物,1mol甲醇燃烧生成CO2(g)和H2O(l)放热238.6kJ,所以1mol甲醇燃烧生成CO2(g)和H2O(g),放出的热量小于燃烧热,故a<238.6;
(2)有1molCl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g) ΔH=-290kJ·mol1;
(3)由图象可知该反应是一个能量降低的反应,所以属于放热反应;ΔH=反应物的总键能-生成物的总键能,所以ΔH=E1-E2= -(E2-E1)kJ/mol;加入催化剂改变了反应的途径,降低反应的活化能,所以E1和E2都减小。


科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验① 观察到的现象是________________________。实验②
观察到的现象是________________________。实验② 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③ 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④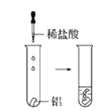 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为___。
(2)已知下列热化学方程式
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -25kJ·mol-1 ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -47kJ·mol-1 ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= +19kJ·mol-1 ③写出FeO(s)被CO还原成Fe和CO2的热化学方程式____。
(3)向足量H2SO4溶液中加入100mL 0.4mol·L-1Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L-1盐酸时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水化学资源开发利用的部分过程如图所示,下列说法正确的是( )
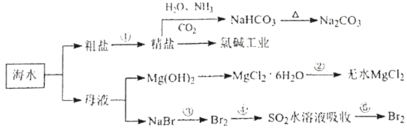
A.用澄清的石灰水可鉴别NaHCO3和Na2CO3
B.从海水中得到粗盐主要是通过蒸发操作实现的
C.在步骤③,中可通入Cl2使溴离子被还原为Br2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和,1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是 ( )

A. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C. 在0≤pH≤5时,HMnO4溶液满足,pH= ![]()
D. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl22CO2H2O
(1)X基态原子的电子排布式为______.
(2)C、H、O三种原子的电负性由大到小的顺序为______.
(3)X2Cl22CO2H2O是一种配合物,其结构如图1所示:
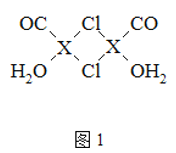
①与CO为互为等电子体的分子是______.
②该配合物中氯原子的杂化方式为______.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______.
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______.XCl的化学式__________
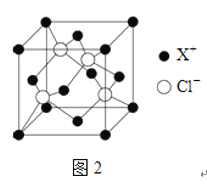
已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加德罗常数NA=_____________(无需化简,列式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件,向一密闭容器中充入一定量CO2气体,并加入足量铁粉,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
T/℃ | 1200 | 1100 | 1000 | 900 | 800 |
K | 0.36 | 0.49 | 1.0 | 1.23 | 1.89 |
(1)该反应的化学平衡常数表达式为K=______。
(2)该反应为______(填“吸热”或“放热”)反应。
(3)能判断该反应是否达到化学平衡状态的依据是____。
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的平均相对分子质量不变 D.c(CO2)=c(CO)
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是_____(填序号)。
A.温度 B.铁粉的量(足量)
C.压强 D.CO的量
(5)在900℃下,该反应达到平衡时,CO2的物质的量浓度为2mol·L-1,则此时c(CO)=____ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图。其中X是一种强碱,G为正盐,通常条件下Z是无色液体,D的相对原子质量比C小16,各物质转化关系如图所示。下列说法正确的是( )
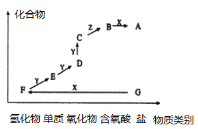
A.D气体一般用排空气法收集B.F和Y在一定条件下不能直接生成C
C.A的水溶液呈酸性D.E→D可用于检验D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com