
【题目】离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图,下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________。
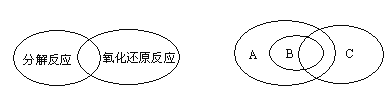
(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________。
(3)离子方程式是重要的化学用语,下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O=2NaOH+H2↑)。
错误观点 | 离子方程式 | |
① | 所有的离子方程式均可以表示一类反应 | _____ |
② | 所有酸碱中和反应均可表示为:H++OH-=H2O | _____ |
【答案】C、A、B AgCl 2Na+2H2O=2Na++2OH-+H2↑ 2H++SO42—+Ba2++2OH-=BaSO4↓+2H2O
【解析】
(1)所有的置换反应全是氧化还原反应,置换反应中有部分是离子反应,部分是非离子反应,氧化还原反应中,有部分是离子反应,部分是非离子反应;
(2)根据离子反应的发生条件可知,离子反应向更难溶的方向移动;
(3)①离子反应可以表示一类反应,但是有的离子反应只表示一个化学反应;
②离子方程式H++OH-=H2O表示强酸和强碱反应生成可溶性的盐和水的中和反应,不能表示强酸和强碱反应生成难溶性的盐和水的中和反应。
(1)所有的置换反应全是氧化还原反应,置换反应中有部分是离子反应,部分是非离子反应,氧化还原反应中,有部分是离子反应,部分是非离子反应,所有的置换反应全是氧化还原反应,是被包含和包含的关系,则A是氧化还原反应,B是置换反应,C是离子反应,故答案为:C、A、B;
(2)根据离子反应的发生条件可知,离子反应向更难溶的方向移动,则将NaBr溶液加入AgCl沉淀中,AgCl白色沉淀转化为AgBr浅黄色沉淀,说明AgCl的溶解度大于AgBr的溶解度,故答案为:,AgCl;
(3)①离子反应可以表示一类反应,但是有的离子反应只表示一个化学反应,比如2Na+2H2O=2Na++2OH-+H2↑只能表示钠和水的反应,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
②离子方程式H++OH-=H2O表示强酸和强碱反应生成可溶性的盐和水的中和反应,不能表示强酸和强碱反应生成难溶性的盐和水的中和反应,比如硫酸和氢氧化钡之间的反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是( )
![]()
A.X可用作木材防火剂
B.步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4
C.步骤Ⅱ中的稀硫酸可用CO2来代替
D.步骤Ⅲ若在实验室完成,一般在蒸发皿中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)= ]。下列说法正确的是( )
]。下列说法正确的是( )
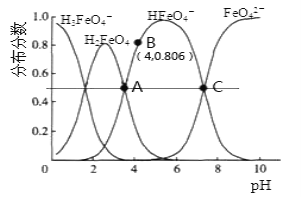
A.K2FeO4、H2FeO4都属于强电解质
B.25℃,H2FeO4+H+![]() H3FeO4+的平衡常数K>100
H3FeO4+的平衡常数K>100
C.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D.A、C两点对应溶液中水的电离程度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G 的顺序依次增大,B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒,D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30,E、F、G的最高价氧化物对应的水化物之间可以相互反应,G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________。
(2)A和D可形成化合物的化学式为__________________。
(3)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为___________。
(4)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为___________。
(5)写出D 元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富镍三元层状氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)作为下一代锂离子电池的正极材被广泛关注和深入研究,纳米级TiO2形成的表面包覆对提高该材料的性能效果明显。回答下列问题:
(1)Li在元素周期表中的位置为___;基态Ni的电子排布式为___,基态Co3+有__个未成对电子。
(2)制备NCM811的过程中,残余的Li2CO3会破坏材料的界面,CO32-的空间构型是___,其中C原子的杂化方式为___。
(3)该电池初始充电过程中,会有C2H4等气体产生。C2H4分子中。![]() 键和
键和![]() 键数目之比为__。
键数目之比为__。
(4)TiO2的晶胞(![]() =
=![]() =
=![]() =90o)如图所示:
=90o)如图所示:
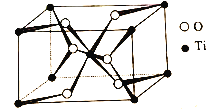
TiO2晶体中O原子的配位数是__,其晶胞参数为:a=b=459pm,c=295pm,该晶体的密度为__g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入6molSO2和3molO2,乙容器恒温恒容,充入6molSO3,丙容器恒温恒压,充入6molSO3,充分反应达到平衡,下列说法正确的是
2SO3(g)ΔH<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入6molSO2和3molO2,乙容器恒温恒容,充入6molSO3,丙容器恒温恒压,充入6molSO3,充分反应达到平衡,下列说法正确的是
A. 乙中SO3的体积分数大于丙
B. 转化率:α甲(SO2)+α乙(SO3)=1
C. 乙和丙中的SO2的生成速率相同
D. 甲和丙中反应的化学平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软质隐形眼镜材料W、树脂X的合成路线如图所示。
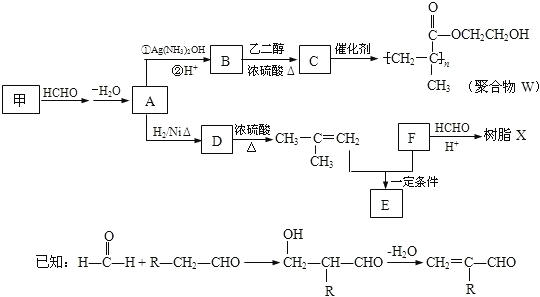
(1)A 中含有的官能团名称是_________。
(2)甲的结构简式是_____________。
(3)B→C反应的化学方程式是______________________________________________。
(4)B有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有______种(不考虑顺反异构,下同),写出其中能发生银镜反应,且含有甲基的所有同分异构体的结构简式是___________。
(5)已知F的相对分子质量为110,分子中碳原子、氢原子数都是氧原子数的3倍,苯环上的氢原子化学环境都相同.则F还能发生的反应是________(填序号)。
A.加成反应 b.氧化反应 c.加聚反应 D.水解反应
(6)写出树脂X可能的结构简式___________(写出一种即可)。
(7)E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,生成E的化学方程式是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com