
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是( )
![]()
A.X可用作木材防火剂
B.步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4
C.步骤Ⅱ中的稀硫酸可用CO2来代替
D.步骤Ⅲ若在实验室完成,一般在蒸发皿中进行
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(1)硫酸工业排出的尾气(主要含SO2)有多种处理方式。
①写出用过量氨水吸收尾气的离子方程式:___________________。
②尾气也可用软锰矿浆(MnO2)吸收,写出如图所示“反应1”的化学方程式:___________________。
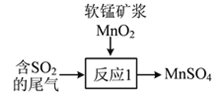
(2)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式:___________________。
(3)某工厂拟综合处理含NH废水和工业废气(主要含N2、Cl2、NO),设计了如下流程:

①“反应1”用于吸收Cl2,“反应1”的化学方程式为___________________。
② “反应2”的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3和1molO2。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g) ΔH =-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2molSO3和1molO2。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.容器内压强P:P丙>P甲=2P乙
B.气体的总物质的量n:n丙>n甲>n乙
C.SO3的体积分数∮:∮甲=∮丙>∮乙
D.反应热量的数值Q:197>Q丙>Q甲>Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
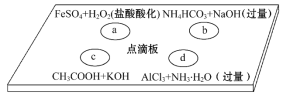
A. a反应:Fe2++2H++H2O2=Fe3++2H2O
B. b反应:HCO3-+OH-=CO32-+H2O
C. c反应:H++OH-=H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO,CH4均为常见的可燃气体。
(1)等体积的CO,CH4在相同的条件下分别完全燃烧,转移的电子数之比为___。
(2)120℃,101kPa下,amL由CO,CH4组成的混合气体在bmL氧气中完全燃烧后,恢复至原来的温度与压强。
①若混合气体与氧气恰好完全反应,产生bmLCO2,则混合气体中CH4的体积分数为__。
②若燃烧后气体体积缩小了![]() mL,则a与b关系的数学表达式为__。
mL,则a与b关系的数学表达式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一带活塞的密闭容器中充入1molN2和3molH2,发生下列反应:N2(g)+3H2(g)2NH3(g),反应达到平衡后,改变下述条件,NH3气体平衡浓度不改变的是( )
A.保持温度和容器压强不变,充入1molNH3(g)
B.保持温度和容器体积不变,充入1molNH3(g)
C.保持温度和容器压强不变,充入1molN2(g)
D.保持温度和容器压强不变,充入1molAr(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,A-E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。
(1)E元素在周期表中的位置为__________;B、C的氢化物稳定性强的是________(用化学式表示,下同);B、C、D组成的化合物中含有的化学键为_____________
(2)D2C2的电子式是_________,将D的单质投入A2C中,反应后得到一种无色溶液,E的单质在该无色溶液中反应的离子方程式为______________;
(3)元素D的单质在一定条件下,能与A单质化合生成氢化物DA,熔点为800℃。DA能与水反应放出氢气,化学反应方程式为_____________。
(4)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下列步骤配制500mL 0.200mol·L-1 Na2CO3溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为_________g。 |
(2)称量Na2CO3固体 | 称量过程中主要用到的仪器是_____ |
(3)将Na2CO3加入100mL烧杯中 | 为加快溶解速率,可采取的措施是___ |
(4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是____________________________________________________________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______ |
(6)你认为按上述步骤配制的Na2CO3溶液的浓度是否为0.200mol·L-1,请说明理由。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图,下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________。
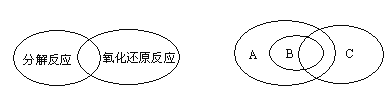
(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________。
(3)离子方程式是重要的化学用语,下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O=2NaOH+H2↑)。
错误观点 | 离子方程式 | |
① | 所有的离子方程式均可以表示一类反应 | _____ |
② | 所有酸碱中和反应均可表示为:H++OH-=H2O | _____ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com