
【题目】CO,CH4均为常见的可燃气体。
(1)等体积的CO,CH4在相同的条件下分别完全燃烧,转移的电子数之比为___。
(2)120℃,101kPa下,amL由CO,CH4组成的混合气体在bmL氧气中完全燃烧后,恢复至原来的温度与压强。
①若混合气体与氧气恰好完全反应,产生bmLCO2,则混合气体中CH4的体积分数为__。
②若燃烧后气体体积缩小了![]() mL,则a与b关系的数学表达式为__。
mL,则a与b关系的数学表达式为__。
【答案】1:4 0.33 b≥![]() a
a
【解析】
(1)相同条件下,体积之比等于物质的量之比,等体积即为等物质的量的CO、CH4完全燃烧都生成二氧化碳,碳元素的化合价变化分别为2、8;
(2)①燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),根据碳原子守恒可知,V(CO+CH4)=V(CO2),故a=b,联立方程可得答案;
②燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),燃烧后体积变化由CO燃烧导致,则: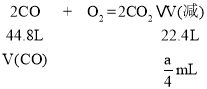 根据完全燃烧可计算答案。
根据完全燃烧可计算答案。
(1)相同条件下,体积之比等于物质的量之比,等体积即为等物质的量的CO、CH4完全燃烧都生成二氧化碳,碳元素的化合价变化分别为2、8,二者完全燃烧转移电子数之比=2:8=1:4,故答案为:1:4;
(2)①燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),根据碳原子守恒可知,V(CO+CH4)=V(CO2),故a=b,则:V(CO)+V(CH4)=a,0.5V(CO)+2V(CH4)=a,解得V(CO)=![]() ,V(CH4)=
,V(CH4)=![]() ,故混合气体中CH4的体积分数为0.33,故答案为:0.33;
,故混合气体中CH4的体积分数为0.33,故答案为:0.33;
②燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),燃烧后体积变化由CO燃烧导致,则: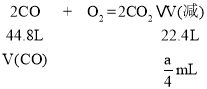 ,故V(CO)=0.5amL,V(CH4)=0.5amL,由于完全燃烧,故0.5V(CO)+2V(CH4)≤b,即0.5a×0.5+2×0.5a≤b,故b≥
,故V(CO)=0.5amL,V(CH4)=0.5amL,由于完全燃烧,故0.5V(CO)+2V(CH4)≤b,即0.5a×0.5+2×0.5a≤b,故b≥![]() a,故答案为:b≥
a,故答案为:b≥![]() a。
a。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠投入水中:Na+2H2O=Na++2OH—+H2↑
B. 用醋酸除去水瓶中的CaCO3:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C. Al溶于NaOH溶液:2Al+2H2O +2OH—=2AlO![]() +3H2↑
+3H2↑
D. Fe与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)工业上若用过量稀硝酸溶解铁屑,则会产生污染性气体,其反应离子方程式是_____。
(2)操作II中,通入硫化氢至饱和的目的是_________;在溶液中用硫酸酸化至pH=2的目的是_____。
(3)常温下,Ksp[Fe(OH)3]=4.0×10-38,则Fe3+的水解常数为_____。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_____。
(5)久置的绿矾(FeSO4·7H2O)被空气中O2部分氧化,生成Fex(OH)y(SO4)z·wH2O。现测定其组成,步骤如下(假设杂质不参与反应,且每步反应均完全进行):
称取三等份固体样品。
第一份样品经足量稀硫酸溶解后,用250mL容量瓶中定容,量取25.00mL待测溶液于锥形瓶中,用0.03mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积为20.00mL(滴定时反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。滴定后溶液经控制pH沉淀Fe3+、过滤、洗涤、烘干并灼烧,最终得到0.32gFe2O3。(Fe2O3式量160)
第二份样品经足量稀盐酸溶解后,再加入过量BaCl2溶液,经过滤、洗涤、烘干,得9.32gBaSO4沉淀。(BaSO4式量233)
第三份样品经高温充分灼烧后,共收集到4.05gH2O。试推导该物质(Fex(OH)y(SO4)z·wH2O)的化学式(写出计算过程,x、y、z、w为最简整数比)______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙醇氧化的反应机理,某研究性学习小组的学生设计了下列实验方案:将一根粗铜丝绕成螺旋状,称得其质量为m1g。另取一支试管,加入3mL乙醇。
(1)将上述已称量过的铜丝放在酒精灯火焰上加热至红热后稍冷,可看到铜丝______(填写现象),再称得其质量为m2g,并且m2________m1(填大于、小于或等于)。
(2)若将红热的铜丝伸入试管中的酒精溶液中,可看到铜丝__________(填写现象)。
(3)反复多次,可闻到试管里溶液有刺激性气味。最后将从酒精中取出的铜丝烘干后称量,其质量为m3g,则m3________m1(填写大于、小于或等于)。
(4)此实验总的化学反应方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 0.5mol雄黄(As4S4),结构如右图,含有NA个S-S键![]()
B. 将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C. 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D. 高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是( )
![]()
A.X可用作木材防火剂
B.步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4
C.步骤Ⅱ中的稀硫酸可用CO2来代替
D.步骤Ⅲ若在实验室完成,一般在蒸发皿中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)用![]() 和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水
和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水![]() ,装置如下图所示。
,装置如下图所示。
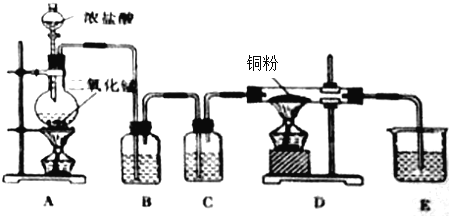
![]()
回答下列问题:
(1)写出在A中发生反应的化学方程式为:_______________________________________________
(2)B中选用的试剂是______________,其作用是________________________;C中选用的试剂是______________,其作用是________________________;E中选用的试剂是_____________,其作用是________________________;
(3)D中反应的化学方程式是________________________________________________
(二)某校化学实验兴趣小组为了探究在实验室制备![]() 的过程中有水蒸气和
的过程中有水蒸气和![]() 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
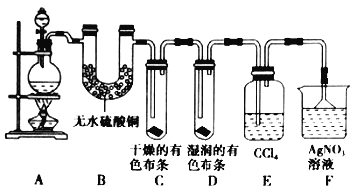
(4)若用含有![]() 的浓盐酸与足量的
的浓盐酸与足量的![]() 反应制
反应制![]() ,制得的
,制得的![]() 体积(标准状况下)总是小于
体积(标准状况下)总是小于![]() 的原因是____________________________________________________。
的原因是____________________________________________________。
(5)①装置B的作用是_______________________________________________,现象是_______________________________________________。
②装置C和D出现的不同现象说明的问题是_______________________________________________。
③装置E的作用是_______________________________________________。
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入![]() 溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入![]() 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________与_________之间(填装置字母序号),装置中应放入____________________________________________。
溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在_________与_________之间(填装置字母序号),装置中应放入____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富镍三元层状氧化物LiNi0.8Co0.1Mn0.1O2(NCM811)作为下一代锂离子电池的正极材被广泛关注和深入研究,纳米级TiO2形成的表面包覆对提高该材料的性能效果明显。回答下列问题:
(1)Li在元素周期表中的位置为___;基态Ni的电子排布式为___,基态Co3+有__个未成对电子。
(2)制备NCM811的过程中,残余的Li2CO3会破坏材料的界面,CO32-的空间构型是___,其中C原子的杂化方式为___。
(3)该电池初始充电过程中,会有C2H4等气体产生。C2H4分子中。![]() 键和
键和![]() 键数目之比为__。
键数目之比为__。
(4)TiO2的晶胞(![]() =
=![]() =
=![]() =90o)如图所示:
=90o)如图所示:
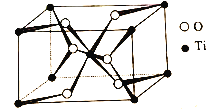
TiO2晶体中O原子的配位数是__,其晶胞参数为:a=b=459pm,c=295pm,该晶体的密度为__g/cm3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com