
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G 的顺序依次增大,B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒,D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30,E、F、G的最高价氧化物对应的水化物之间可以相互反应,G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________。
(2)A和D可形成化合物的化学式为__________________。
(3)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为___________。
(4)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为___________。
(5)写出D 元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_______________。
【答案】![]() H2O和H2O2 2Al+ 2OH-+2H2O=2AlO2-+3H2↑ 共价键 H2S+2OH-=S2-+2H2O或HS-+OH-=S2-+H2O
H2O和H2O2 2Al+ 2OH-+2H2O=2AlO2-+3H2↑ 共价键 H2S+2OH-=S2-+2H2O或HS-+OH-=S2-+H2O
【解析】
7种短周期元素的原子序数按A、B、C、D、E、F、G的顺序依次增大;B元素一种原子的含量常用于判定古生物遗体的年代,则B为碳元素;A和C元素的原子能形成4核10电子的微粒,结合原子序数可知A为氢元素、C为氮元素;D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30,故E+、D2-离子核外电子数均为10,则D为氧元素、E为钠元素;E、F、G的最高价氧化物对应的水化物之间可以相互反应,是氢氧化铝与强碱、强酸之间的反应,则F为Al;G和D同主族,则G为硫元素,然后根据问题逐一分析解答。
根据上述分析可知:A是H,B是C,C是N,D是O,E是Na,F是Al,G是S元素。
(1) C是7号N元素,原子核外电子排布为2、5,所以N的原子结构示意图为![]() ;
;
(2) A是H,D是O,A和D可形成两种化合物,它们的化学式为H2O和H2O2;
(3)F是Al,E是Na,Na的最高价氧化物对应的水化物是NaOH,Al与NaOH溶液反应产生NaAlO2和H2,反应的离子方程式为2Al+ 2OH-+2H2O=2AlO2-+3H2↑;
(4)上述元素形成的二元化合物中,能够用于漂白的气体物质是SO2,该物质是共价化合物,S、O原子通过共价键结合,所以其中含有的化学键类型为共价键;
(5)D是O,G是S,D 元素原子形成的10电子微粒X是OH-,G元素原子形成的18电子微粒Y是H2S或HS-,它们之间反应的离子方程式为:H2S+2OH-=S2-+2H2O或HS-+OH-=S2-+H2O。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
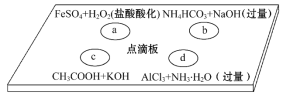
A. a反应:Fe2++2H++H2O2=Fe3++2H2O
B. b反应:HCO3-+OH-=CO32-+H2O
C. c反应:H++OH-=H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下列步骤配制500mL 0.200mol·L-1 Na2CO3溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为_________g。 |
(2)称量Na2CO3固体 | 称量过程中主要用到的仪器是_____ |
(3)将Na2CO3加入100mL烧杯中 | 为加快溶解速率,可采取的措施是___ |
(4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是____________________________________________________________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______ |
(6)你认为按上述步骤配制的Na2CO3溶液的浓度是否为0.200mol·L-1,请说明理由。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH1=-572kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1367kJ/mol
则2C(s)+3H2(g)+![]() O2(g)=C2H5OH(l),ΔH为( )
O2(g)=C2H5OH(l),ΔH为( )
A.+278kJ/molB.-278kJ/molC.+401.5kJ/molD.-401.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(__________)两种物质都不是电解质
(__________)两种物质都是钠的化合物
(__________)两种物质都是氧化物
(__________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1 mol/L的如图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为______________。
②证明有红褐色胶体生成的实验原理是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图,下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________。
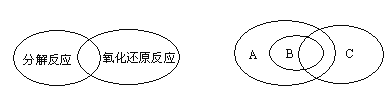
(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________。
(3)离子方程式是重要的化学用语,下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O=2NaOH+H2↑)。
错误观点 | 离子方程式 | |
① | 所有的离子方程式均可以表示一类反应 | _____ |
② | 所有酸碱中和反应均可表示为:H++OH-=H2O | _____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在学习了硫的转化后,某学生绘制了如图所示的转化关系。
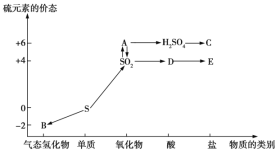
(1)写出指定物质的化学式:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)写出“![]() ”的化学方程式:______(写一个即可)。
”的化学方程式:______(写一个即可)。
(3)写出一个由![]() 直接生成
直接生成![]() 的化学方程式:____________。
的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化铁是现代电子工业的重要材料。
(1)以赤铁矿(主要成分:Fe2O3,杂质为FeO、Al2O3、SiO2、CuO等)为原料可制备高纯氧化铁,制备流程如下:
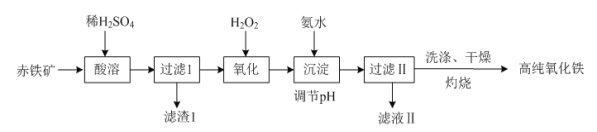
①“酸溶”时Al2O3发生反应的化学方程式为_________________________________。
②“氧化”时发生反应的离子方程式为____________________________。
③“灼烧”时发生反应的化学方程式为______________________________。
④滤渣Ⅰ的主要成分与NaOH溶液反应的离子方程式为_______________________________。
(2)FeCO3在空气中高温灼烧也可以制备高纯氧化铁,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com