
【题目】高纯氧化铁是现代电子工业的重要材料。
(1)以赤铁矿(主要成分:Fe2O3,杂质为FeO、Al2O3、SiO2、CuO等)为原料可制备高纯氧化铁,制备流程如下:
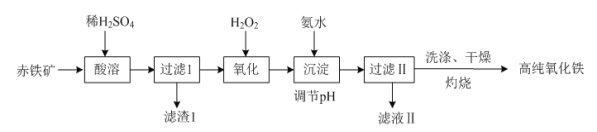
①“酸溶”时Al2O3发生反应的化学方程式为_________________________________。
②“氧化”时发生反应的离子方程式为____________________________。
③“灼烧”时发生反应的化学方程式为______________________________。
④滤渣Ⅰ的主要成分与NaOH溶液反应的离子方程式为_______________________________。
(2)FeCO3在空气中高温灼烧也可以制备高纯氧化铁,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:_________。
【答案】Al2O3+3H2SO4===Al2(SO4)3+3H2O 2Fe2++H2O2+2H+===2Fe3++2H2O 2Fe(OH)3 ![]() Fe2O3+3H2O SiO2+2OH-===SiO32—+H2O
Fe2O3+3H2O SiO2+2OH-===SiO32—+H2O 
【解析】
由流程图可知,向赤铁矿中加入稀硫酸酸溶时,氧化铁、氧化亚铁、氧化铝和氧化铜溶于稀硫酸,二氧化硅不溶,则过滤后得到含有铁离子、铝离子、铜离子和亚铁离子的滤液和滤渣二氧化硅;向滤液中加入双氧水,双氧水将亚铁离子氧化为铁离子,氧化后再加入氨水调节溶液pH,使铁离子完全转为氢氧化铁沉淀,则过滤后得到含有铝离子、铜离子的滤液和滤渣氢氧化铁;氢氧化铁沉淀沉淀经洗涤、干燥、灼烧得到高纯氧化铁。
(1)①“酸溶”时,Al2O3与稀硫酸反应生成硫酸铝和水,反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O,故答案为:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
②“氧化”时,双氧水将亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③“灼烧”时,氢氧化铁受热分解生成氧化铁和水,反应的化学方程式为2Fe(OH)3 ![]() Fe2O3+3H2O,故答案为:2Fe(OH)3
Fe2O3+3H2O,故答案为:2Fe(OH)3 ![]() Fe2O3+3H2O;
Fe2O3+3H2O;
④滤渣Ⅰ的主要成分是二氧化硅,二氧化硅与NaOH溶液反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32—+H2O,故答案为:SiO2+2OH-=SiO32—+H2O;
(2)FeCO3在空气中高温灼烧生成氧化铁时,铁元素化合价升高被氧化说明FeCO3做还原剂,空气中氧气做氧化剂,4mol FeCO3反应,转移的电子数目为4mol,则电子转移的方向和数目为 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】有7种短周期元素的原子序数按A、B、C、D、E、F、G 的顺序依次增大,B元素一种原子的含量常用于判定古生物遗体的年代,A和C元素的原子能形成4核10电子的微粒,D和E可形成离子化合物E2D,E2D中所有微粒的电子数相同,且电子总数为30,E、F、G的最高价氧化物对应的水化物之间可以相互反应,G和D同主族。试回答下列问题:
(1)C元素的原子结构示意图____________。
(2)A和D可形成化合物的化学式为__________________。
(3)F的单质与E元素的最高价氧化物对应的水化物反应的离子方程式为___________。
(4)上述元素形成的二元化合物中,能够用于漂白的气体物质中含有的化学键类型为___________。
(5)写出D 元素原子形成的10电子微粒X与G元素原子形成的18电子微粒Y反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入6molSO2和3molO2,乙容器恒温恒容,充入6molSO3,丙容器恒温恒压,充入6molSO3,充分反应达到平衡,下列说法正确的是
2SO3(g)ΔH<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入6molSO2和3molO2,乙容器恒温恒容,充入6molSO3,丙容器恒温恒压,充入6molSO3,充分反应达到平衡,下列说法正确的是
A. 乙中SO3的体积分数大于丙
B. 转化率:α甲(SO2)+α乙(SO3)=1
C. 乙和丙中的SO2的生成速率相同
D. 甲和丙中反应的化学平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的用法中,正确的是
A. BaCO3的电离方程式:BaCO3![]() Ba2++CO32—
Ba2++CO32—
B. 向沸水中滴加饱和氯化铁溶液得到红褐色液体的化学方程式:3H2O+FeCl3=3HCl+Fe(OH)3↓
C. 向酸性KI溶液中通入臭氧(O3)的离子方程式:2I—+O3+H2O==I2+O2+2OH—
D. 向Ba(OH)2溶液中滴入 NaHSO4溶液至恰好完全沉淀时,反应的离子方程式Ba2++OH—+SO42—+H+==BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol·L-1的盐酸溶液。
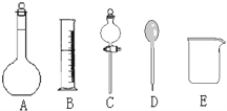
(1)在图所示仪器中,配制上述溶液不需要的是________(填序号);除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
(2)根据计算,下列量程或规格中,本实验量筒应使用的是________;
A.10mL B.100mL C.250mL D.500mL
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)________。
①待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)在容量瓶的使用方法中,下列操作正确的是________。
A.使用容量瓶前不用检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线处,1~2cm用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(5)若定容后摇匀静置,发现凹液面低于刻度线,此时应该________。
A.直接转移到细口试剂瓶中
B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制
D.直接贮存于容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯化反应是酸与醇发生反应生成酯和水的反应。下列反应属于酯化反应的是( )
A.CH3COOH+NaOH→CH3COONa+H2O
B.CH2==CHCOOCH3+H2![]() CH3CH2COOCH3
CH3CH2COOCH3
C.CH3COOCH2CH3+H2O![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
D.2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软质隐形眼镜材料W、树脂X的合成路线如图所示。
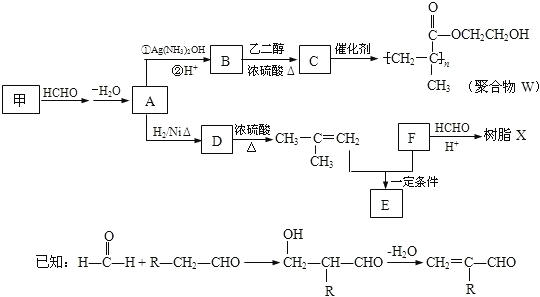
(1)A 中含有的官能团名称是_________。
(2)甲的结构简式是_____________。
(3)B→C反应的化学方程式是______________________________________________。
(4)B有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有______种(不考虑顺反异构,下同),写出其中能发生银镜反应,且含有甲基的所有同分异构体的结构简式是___________。
(5)已知F的相对分子质量为110,分子中碳原子、氢原子数都是氧原子数的3倍,苯环上的氢原子化学环境都相同.则F还能发生的反应是________(填序号)。
A.加成反应 b.氧化反应 c.加聚反应 D.水解反应
(6)写出树脂X可能的结构简式___________(写出一种即可)。
(7)E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,生成E的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 按要求对下图中两极进行必要的连接并填空:
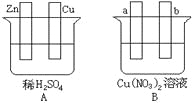
(1)在A图中请加以必要连接,使锌片不断损耗,铜片上冒H2气泡。则连接后的装置叫_______。
电极反应式:锌板:_______;铜板:_______。
(2)在B图中a、b均是惰性电极,加以必要的连接后,使a极析出铜, b极放出气体。该装置叫_______。
电极反应式:a极_______b极:_______。
经过一段时间后,停止反应并搅匀溶液,溶液的pH值_______(填 “升高、降低或不变”),加入一定量的_______后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=___。(用ΔH1、ΔH2、ΔH3表示)
II.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
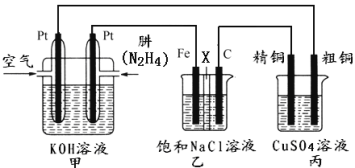
根据要求回答相关问题:
(1)甲装置中通入___气体的一极为正极。
(2)乙装置中石墨电极为___极,其电极反应式为__;可以用__检验该反应产物,电解一段时间后,乙池中的溶液呈__性。
(3)图中用丙装置模拟工业中的___原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为__g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com