
【题目】Ⅰ.肼(N2H4)又称联氨,常温时是一种可燃性液体,可用作火箭燃料。
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=___。(用ΔH1、ΔH2、ΔH3表示)
II.如图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
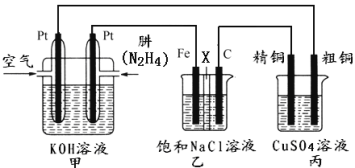
根据要求回答相关问题:
(1)甲装置中通入___气体的一极为正极。
(2)乙装置中石墨电极为___极,其电极反应式为__;可以用__检验该反应产物,电解一段时间后,乙池中的溶液呈__性。
(3)图中用丙装置模拟工业中的___原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为__g。
【答案】ΔH4=2ΔH3-2ΔH2-ΔH1 空气 阳 2Cl--2e-=Cl2↑ 湿润的碘化钾淀粉试纸(或用玻璃棒蘸取浓氨水或湿润的蓝色石蕊试纸或湿润的有色布条等) 碱 粗铜的精炼 0.8
【解析】
Ⅰ.根据盖斯定律分析计算;
II.燃料电池中通入燃料的电极为负极,通入空气的电极为正极,结合原电池原理和电解池原理分析解答。
Ⅰ.①①2O2(g)+N2(g)=N2O4(l) ΔH1,②N2(g)+2H2(g)=N2H4(l) ΔH2,③O2(g)+2H2(g)=2H2O(g) ΔH3,所求反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),根据盖斯定律,由③×2-②-①得到,反应的焓变△H4=2△H2-2△H3-△H1,故答案为:2△H2-2△H3-△H1;
II.(1)甲为燃料电池,通入燃料的电极为负极,通入空气的电极为正极,故答案为:空气;
(2)乙装置中石墨与电源正极相连,为阳极,阳极上发生氧化反应,氯离子失去电子生成氯气,电极反应式为2Cl--2e-=Cl2↑,可以用湿润的淀粉碘化钾试纸,检验氯气,观察试纸是否变蓝,电解食盐水的总反应为2H2O+2Cl-![]() Cl2↑+H2↑+2OH-,因此电解后的溶液呈碱性,故答案为:阳;2Cl--2e-=Cl2↑;湿润的淀粉碘化钾试纸;碱;
Cl2↑+H2↑+2OH-,因此电解后的溶液呈碱性,故答案为:阳;2Cl--2e-=Cl2↑;湿润的淀粉碘化钾试纸;碱;
(3)装置丙中,粗铜作阳极,纯铜作阴极,所以该装置为粗铜精炼装置;原电池负极和纯铜电极上有:N2H4~N2~4e-,Cu~Cu2+~2e-,根据电子守恒得到关系式:N2H4~2Cu,n(N2H4)=![]() n(Cu)=
n(Cu)=![]() ×
×![]() =0.025mol,m(N2H4)=nM=0.025mol×32g/mol=0.8g,故答案为:粗铜的精炼;0.8。
=0.025mol,m(N2H4)=nM=0.025mol×32g/mol=0.8g,故答案为:粗铜的精炼;0.8。


科目:高中化学 来源: 题型:
【题目】高纯氧化铁是现代电子工业的重要材料。
(1)以赤铁矿(主要成分:Fe2O3,杂质为FeO、Al2O3、SiO2、CuO等)为原料可制备高纯氧化铁,制备流程如下:
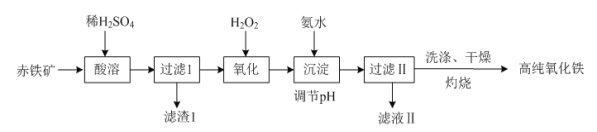
①“酸溶”时Al2O3发生反应的化学方程式为_________________________________。
②“氧化”时发生反应的离子方程式为____________________________。
③“灼烧”时发生反应的化学方程式为______________________________。
④滤渣Ⅰ的主要成分与NaOH溶液反应的离子方程式为_______________________________。
(2)FeCO3在空气中高温灼烧也可以制备高纯氧化铁,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铜与过量浓硫酸反应的实验说法不正确的是( )
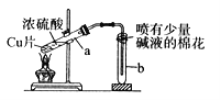
A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )

A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证木炭可被浓硫酸氧化成![]() ,选用如图所示装置(内含物质)进行实验。
,选用如图所示装置(内含物质)进行实验。
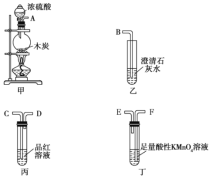
(1)按气流由左向右的流向,连接如图所示装置的正确顺序是______(填字母,下同)接______,______接______,______接______。
(2)若实验检验出有![]() 生成,则装置乙、丙中的现象分别为:装置乙中______,装置丙中______。
生成,则装置乙、丙中的现象分别为:装置乙中______,装置丙中______。
(3)装置丁中酸性![]() 溶液的作用是______。
溶液的作用是______。
(4)写出装置甲中所发生反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列10种物质:①O2;②H2;③NH4NO3;④Na2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2。其中既含离子键又含非极性键的是________(填序号,下同);既含离子键又含极性键的是________;。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子。若XY2为常见元素形成的离子化合物,则其电子式为______________________________________________;若XY2为共价化合物,则其结构式为_________________________________________。
(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝是______________(填“共价化合物”或“离子化合物”),可以证明该判断正确的实验依据是_______________________________________。
(4)现有a~g七种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
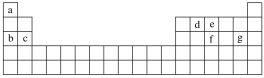
元素的原子间最容易形成离子键的是____(填字母,下同),容易形成共价键的是____。
A.c和f B.b和g C.d和g D.b和e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:

(1)基态硅原子电子占据的最高能层符号是_____,其中能量最高的电子所占据能级的原子轨道有_____个伸展方向,原子轨道呈_____形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________(用元素符号表示)。H2SeO3的酸性_______H2SeO4(填“强于”或“弱于”),原因是___________(从分子结构的角度回答)。
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如右图所示。六方相氮化硼______π键(填“含有”或“不含”),其质地软的原因是_________。NaBH4是一种重要的储氢载体,阴离子的的立体结构_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体的流程如下:
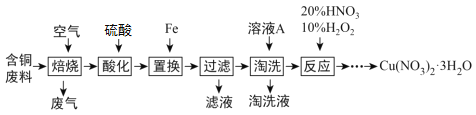
(1) “焙烧”时CuS转化为CuO和SO2,反应的化学方程式为_________________________。
(2) “酸化”步骤反应的离子方程式为______________________________。
(3) “过滤”所得滤液中溶质的主要成分为__________。
(4) “淘洗”所用的溶液A应选用______(填序号)。
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(5) ①“反应”一步的过程中发生反应Cu+2HNO3+H2O2=Cu(NO3)2+2H2O。该反应中被还原的物质为__________。
②“反应”一步中若不加10% H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体NO2,请写出该反应的离子方程式____________________。
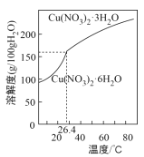
(6) 由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是___________________________________________________________________________。(相关物质的溶解度曲线如图所示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com