


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
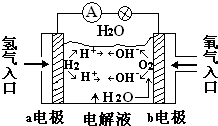 如图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述中不正确的是( )
如图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述中不正确的是( )| A、a电极是负极 |
| B、b电极的电极反应式为4OH--4e-=2H2O+O2↑ |
| C、在电池内部,H+向a电极附近运动 |
| D、氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
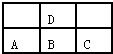 如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )| A、D与C不能形成化合物 |
| B、D的最高正价与B的最高正价相等 |
| C、A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A |
| D、A、B、C、D原子所具有的原子轨道类型和数目都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
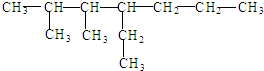 的命名中正确的是( )
的命名中正确的是( )| A、2,3-二甲基-4-丙基己烷 |
| B、2,3-二甲基-4-乙基庚烷 |
| C、4-乙基-2,3-二甲基庚烷 |
| D、5,6-二甲基-4-乙基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
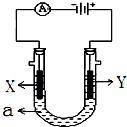 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com