
【题目】下列离子方程式不正确的是 ( )
A. 澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓ +CO32-+2H2O
B. 用惰性电极电解NaHS溶液:HS-+ H2O![]() S↓+H2↑+OH-
S↓+H2↑+OH-
C. 向摩尔盐溶液中加入过量的Ba(OH)2溶液:2NH4+ + Fe2+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ Fe(OH)2↓+ 2NH3·H2O
D. 明矾溶液中加入Ba(OH)2溶液至生成的沉淀质量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾![]() 是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
是一种新型、高效、多功能水处理剂。某学习小组设计如下方案制备高铁酸钾:
![]()
①高铁酸钾中铁元素的化合价为________,据此推测它具有的化学性质是____________。
②其中第一步操作是:在NaClO溶液中加入烧碱固体形成强碱性环境,将研磨过的硝酸铁少量多次地加入上述溶液中,冰水浴中反应1 h。发生的离子反应为2Fe3++3ClO-+10OH-===2FeO![]() +3Cl-+5H2O,还原剂是_____________。
+3Cl-+5H2O,还原剂是_____________。
③高铁酸钾和水发生反应,生成物能吸附杂质净水,同时还产生气体,写出反应的离子方程式:___________________。
(2)某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入![]() ,然后再加过量的氨水,过滤;
,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是_________;加入![]() 的主要目的是________________。
的主要目的是________________。
③步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
④若要检验溶液中的![]() ,则应该加入________________试剂。
,则应该加入________________试剂。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g),K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲有镇咳、镇静的功效,其合成路线如下:
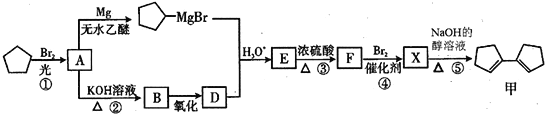
已知: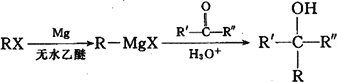 (R、R'、R"代表烃基或氢)
(R、R'、R"代表烃基或氢)
(1)有机物甲的分子式为___________,有机物A中含有的官能团的名称为_________________。
(2)有机物B的名称是____________,由B→D 所需的反应试剂和反应条件为_______________。
(3)在上述①~⑤反应中,属于取代反应的有____________(填序号)。
(4)写出E→F的化学方程式____________________________。
(5)写出同时满足下列条件的甲的同分异构体的结构简式________。
(Ⅰ)属于芳香族化合物 (Ⅱ)核磁共振氢谱上只有2组峰
(6)根据题给信息,写出以CH4为原料制备CH3CHO的合成路线(其他试剂任选)___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题:
![]()
(1)若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B
转化为C的化学方程式是_______________________;
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B 的化学式是_____________;
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是___________________符合条件的D物质可能是___________(填序号)。
①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将0.2 molC(S)和0.3 mol H2O(g)投入2L的密闭容器中,发生反应C(S)+H2O(g)![]() CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
CO + H2 5min达到平衡后,密度增加了0.3g/L。有关下列说法正确的是( )
A. 从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 molL-1min-1
B. 达平衡时压强变为原来的7/6
C. 此温度下该反应的平衡常数为0.0125
D. 若保持温度和体积不变,向平衡体系中再加入0.2 molC(S)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液里只含有下列7种离子中的某几种:Mg2+ 、H+ 、Ag+ 、Na+ 、Cl- 、HCO3- 、OH- 。已知:该溶液能跟金属铝反应,且放出氢气。试回答:
(1)若铝跟溶液反应后只有AlO2-生成,则原溶液一定含有的大量离子是_______ ,发生该反应的离子方程式是__________;还可能含有离子是__________。
(2)若铝跟溶液反应后只有Al3+生成,则原溶液中一定不能大量含有的离子是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
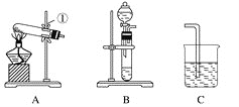
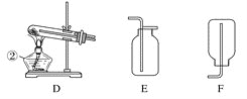
(1)写出仪器名称:①________,②________。
(2)实验室制取并收集氧气时,应选择____________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验时,应选择________和________相连接,检验生成气体时使用的试剂是________,检验气体时观察到的实验现象是_________________。
(4)制取氢气并做还原氧化铜的实验时,应选择______和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com