
【题目】欲使NH4Cl稀溶液中c(NH4+)/c(Cl-)比值增大,可在溶液中(恒温并忽略溶液体积的变化)加入少量下列物质中的( )
①通入HCl;②H2SO4;③NH4Cl固体;④NH4NO3固体 ⑤Ba(OH)2固体
A.②或③或④B.①或②或④C.②或③或⑤D.①或③或⑤
【答案】A
【解析】
在NH4Cl稀溶液中,存在下列平衡:NH4++ H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
①通入HCl,平衡逆向移动,c(NH4+)增大,c(Cl-)增大,但c(Cl-)增大更多,所以c(NH4+)/c(Cl-)比值减小,①不合题意;
②加入H2SO4,平衡逆向移动,c(NH4+)增大,c(Cl-)不变,所以c(NH4+)/c(Cl-)比值增大,②符合题意;
③加入NH4Cl固体,相当于增大NH4Cl的浓度,水解程度减小,所以c(NH4+)/c(Cl-)比值增大,③符合题意;
④加入NH4NO3固体,平衡正向移动,c(NH4+)增大,c(Cl-)不变,所以c(NH4+)/c(Cl-)比值增大,②符合题意;
⑤加入Ba(OH)2固体,与H+反应,促使平衡正向移动,c(NH4+)减小,c(Cl-)不变,所以c(NH4+)/c(Cl-)比值减小,⑤不合题意。
综合以上分析,②或③或④符合题意。故选A。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,保护环境人人有责。直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A. c(Na+)=2c(SO32-)+c(HSO3-)
B .c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C. c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)氮的氢化物之一肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液,负极的电极反应式是_______________,若使用该电池做电源,惰性电极电解500mL 1mol/L的CuSO4溶液,一段时间后溶液的PH=1,消耗的N2H4质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)在实验室中,![]() 可用铁粉和______反应制备,
可用铁粉和______反应制备,![]() 可用铁粉和______反应制备。
可用铁粉和______反应制备。
(2)黄铁矿![]() 主要成分为
主要成分为![]() 是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
![]() ,该过程中若有
,该过程中若有![]()
![]() 参加反应,则反应过程中转移______mol电子。
参加反应,则反应过程中转移______mol电子。
(3)![]() 与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:
与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:![]() ,放电时电池的负极反应式为______;充电时电解液的pH______
,放电时电池的负极反应式为______;充电时电解液的pH______![]() 填“增大”“减小”或“不变”之一
填“增大”“减小”或“不变”之一![]() 。
。
(4)某同学向盛有![]() 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的![]() 溶液,溶液变成棕黄色,发生反应的离子方程式为______;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______
溶液,溶液变成棕黄色,发生反应的离子方程式为______;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______![]() 用平衡移动原理解释
用平衡移动原理解释![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
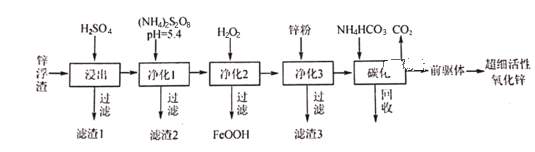
(1)滤渣1的成分为___________。
(2)在S2O82-的结构式中只含有一根“O一O”非极性键,则S的化合价为___________;工业上常用惰性电极电解(NH4)2SO4生产(NH4)2S2O8(过二硫酸铵),阳极电极反应式为__________________。净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:______________________。
(3)净化3的目的_________________________________。
(4)碳化回收溶液的主要成分为___________,该物质循环使用的目的___________________。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从工业废钒中回收金属钒既避免污染环境又有利于资源综合利用。某工业废钒的主要成分为V2O5、VOSO4和SiO2等,下图是从废钒中回收钒的一种工艺流程:

(1)为了提高“酸浸”效率,可以采取的措施有________(填两种).
(2)“还原”工序中反应的离子方程式为________.
(3)“沉钒”得到NH4VO3沉淀,需对沉淀进行洗涤,检验沉淀完全洗净的方法是________.
(4)写出流程中铝热反应的化学方程式________.
(5)电解精炼时,以熔融NaCl、CaCl2和VCl2为电解液(其中VCl2以分子形式存在).粗钒应与电源的________极(填“正”或“负”)相连,阴极的电极反应式为________.
(6)为预估“还原”工序加入H2C2O4的量,需测定“酸浸”液中VO2+的浓度.每次取25.00mL“酸浸”液于锥形瓶用a mol/L(NH4)2Fe(SO4)2标准溶液和苯代邻氨基苯甲酸为指示剂进行滴定(其中VO2+ VO2+),若三次滴定消耗标准液的体积平均为bmL,则VO2+的浓度为________g/L(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源,降低碳的排放,实施低碳经济是今后经济生活主流方向。
(1)下列措施不利于有效减少二氧化碳排放的是________。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
(2)CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO2和6 mol H2,发生:CO2(g)+3H2(g )![]() CH3OH(g)+H2O(g),现测得CO2和CH3OH(g)的浓度随时间变化如下图1所示。从反应开始到平衡时CO2的转化率为_________。氢气的平均反应速率v(H2)=_______mol/(L·min)。该温度下的平衡常数为________。
CH3OH(g)+H2O(g),现测得CO2和CH3OH(g)的浓度随时间变化如下图1所示。从反应开始到平衡时CO2的转化率为_________。氢气的平均反应速率v(H2)=_______mol/(L·min)。该温度下的平衡常数为________。
(3)CO在催化作用下生成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g)。已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如图所示。
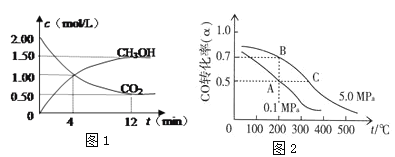
①该反应的ΔH_____0;ΔS____0。 (填“>、=、<”)
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA ____ tC(填“>、=、<”)
③A、B、C三点对应的平衡常数分别为KA、KB、KC,则的大小关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃料电池体积小巧、燃料使用便利、洁净环保、理论能量比高,用甲烷燃料电池为下图电解装置供电,工作一段时间后,A池中左右试管收集到的气体体积比为2:1,则:
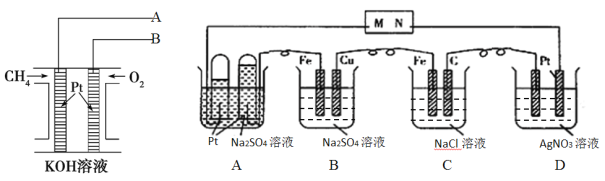
(1)电解一段时间后,甲烷燃料电池中溶液的pH_________。(填“增大、减小或不变”)
(2)甲烷燃料电池中导线A与电解池中的_________(填M或N)导线连接
(3)B池中一段时间后实验现象______________________________________________。
(4)相同条件下,电解质足量的A、B、C、D池中生成气体的总体积由大到小的顺序为_______。
(5)D池电解一段时间后,若要使电解质溶液恢复到电解前的状态,可加入________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com