
【题目】甲烷燃料电池体积小巧、燃料使用便利、洁净环保、理论能量比高,用甲烷燃料电池为下图电解装置供电,工作一段时间后,A池中左右试管收集到的气体体积比为2:1,则:
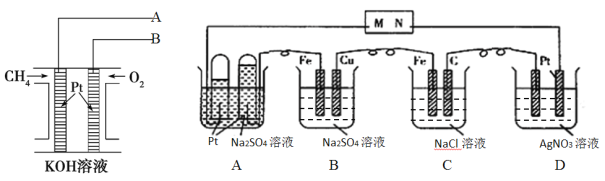
(1)电解一段时间后,甲烷燃料电池中溶液的pH_________。(填“增大、减小或不变”)
(2)甲烷燃料电池中导线A与电解池中的_________(填M或N)导线连接
(3)B池中一段时间后实验现象______________________________________________。
(4)相同条件下,电解质足量的A、B、C、D池中生成气体的总体积由大到小的顺序为_______。
(5)D池电解一段时间后,若要使电解质溶液恢复到电解前的状态,可加入________。
【答案】减小 M 铁电极周围有气泡产生,铜电极溶解,电解质溶液逐渐变蓝色 C>A>B>D Ag2O或Ag2CO3
【解析】
(1)甲烷燃料电池中发生的电池反应为CH4+2O2+2OH-=CO32-+3H2O,由此可得出溶液的pH变化。
(2) A池中左右试管收集到的气体体积比为2:1,则左边试管内的Pt电极为阴极,与它相连的为电源的负极,甲烷燃料电池中导线A为负极,应与阴极相连,由此得出与电解池中的导线的连接方式。
(3)B池中,Fe电极为阴极,发生反应为4H2O+4e-=4OH-+2H2↑;Cu电极为阳极,发生反应为2Cu-4e-=2Cu2+,由此可得出一段时间后实验现象。
(4)A池中电极反应为:阳极2H2O-4e-=O2↑+4H+,阴极4H2O+4e-=4OH-+2H2↑;B池,阴极4H2O+4e-=4OH-+2H2↑,阳极2Cu-4e-=2Cu2+;C池:阳极4Cl--4e-=2Cl2↑,阴极4H2O+4e-=4OH-+2H2↑;D池:阳极2H2O-4e-=O2↑+4H+,阴极4Ag++4e-=4Ag。假设线路中通过的电子为4mol,则相同条件下,电解质足量的A、B、C、D池中生成气体的总物质的量分别为3mol、2mol、4mol、1mol,由此得出生成气体的总体积由大到小的顺序。
(5)D池电解一段时间后,阳极生成O2,阴极生成Ag,将两电极产物进行反应,然后放入电解质溶液中,就可恢复到电解前的状态。
(1)电解一段时间后,甲烷燃料电池中发生的电池反应为CH4+2O2+2OH-=CO32-+3H2O,从电池反应可以看出,甲烷燃烧过程中需要消耗KOH,则溶液的pH减小。答案为:减小;
(2) A池中左右试管收集到的气体体积比为2:1,则左边试管内的Pt电极为阴极,与它相连的为电源的负极,甲烷燃料电池中导线A为负极,应与阴极相连,由此得出导线A与电解池中的M导线连接。答案为:M;
(3)B池中,Fe电极为阴极,发生反应为4H2O+4e-=4OH-+2H2↑;Cu电极为阳极,发生反应为2Cu-4e-=2Cu2+,由此可得出一段时间后实验现象为铁电极周围有气泡产生,铜电极溶解,电解质溶液逐渐变蓝色。答案为:铁电极周围有气泡产生,铜电极溶解,电解质溶液逐渐变蓝色;
(4)A池中电极反应为:阳极2H2O-4e-=O2↑+4H+,阴极4H2O+4e-=4OH-+2H2↑;B池,阳极2Cu-4e-=2Cu2+,阴极4H2O+4e-=4OH-+2H2↑;C池:阳极4Cl--4e-=2Cl2↑,阴极4H2O+4e-=4OH-+2H2↑;D池:阳极2H2O-4e-=O2↑+4H+,阴极4Ag++4e-=4Ag。假设线路中通过的电子为4mol,则相同条件下,电解质足量的A、B、C、D池中生成气体的总物质的量分别为3mol、2mol、4mol、1mol,由此得出生成气体的总体积由大到小的顺序为C>A>B>D。答案为:C>A>B>D;
(5)D池电解一段时间后,阳极生成O2,阴极生成Ag,若要使电解质溶液恢复到电解前的状态,可加入Ag2O或Ag2CO3。答案为:Ag2O或Ag2CO3。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.泡沫灭火器的原理:Al3++3HCO3-![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C.HCO3的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使NH4Cl稀溶液中c(NH4+)/c(Cl-)比值增大,可在溶液中(恒温并忽略溶液体积的变化)加入少量下列物质中的( )
①通入HCl;②H2SO4;③NH4Cl固体;④NH4NO3固体 ⑤Ba(OH)2固体
A.②或③或④B.①或②或④C.②或③或⑤D.①或③或⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )

A.Cr含量小于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
B.Cr含量等于13%时,三种酸对Fe-Cr合金的腐蚀速率由快到慢的顺序为H2SO4>HCl>HNO3
C.随着Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蚀性越来越弱
D.稀硫酸对Fe-Cr合金的腐蚀性比稀硝酸和稀盐酸都强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种药物合成的中间体,F的一种合成路线如下:

已知:

回答下列问题:
(1)![]() 的名称为____。
的名称为____。
(2)D中含氧官能团的名称为____。
(3)B→C的反应方程式为____。
(4)D→E的反应类型为____。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____。
(6)依他尼酸钠( )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以![]() 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
(1)含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:
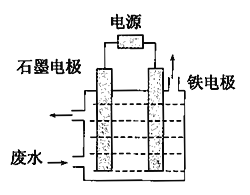
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为_____________(填“阴极”或“阳极”),阳极产生的ClO-的电极反应为_______________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为___________________________________。
(2)可用以下方法测定处理后的废水中NaCN的含量。已知:Ⅰ.废水中NaCN 的最高排放标准为0.50mg/L;Ⅱ.Ag+ +2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI沉淀呈黄色,且CN- 优先与Ag+反应。实验如下:20.00mL处理后的含NaCN 的废水于锥形瓶中,并滴加几滴KI 溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为15.00mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用_________________(填仪器名称)盛装;滴定终点时的现象是____________________________。
②处理后的含NaCN 的废水是否达到排放标准____________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
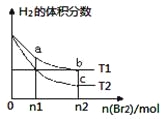
A. 若b、c点的平衡常数分别为K1、K2,则K1>K2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D. 若平衡后保持温度不变,压缩容器体积平衡一定不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒温恒压密闭容器中投入2molSO3发生反应:2SO3(s) ![]() 2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后达到平衡,此时SO2的物质的量为0.8mol,下列说法正确的是( )
2SO2(g)+O2(g) △H= +akJ·mol-1(a>0),2min后达到平衡,此时SO2的物质的量为0.8mol,下列说法正确的是( )
A.用SO3表示的反应速率为0.2mol·L-1·min-1
B.若O2的体积分数不变,证明该可逆反应已达平衡
C.在2min时,v正(SO2)=2v逆(O2)
D.平衡后,再投入2 mol SO3,则正反应速度加快,逆反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或物质的性质描述正确的是( )
A. 乙烯在一定条件下能发生加成反应,加聚反应,被酸性高锰酸钾溶液氧化
B. 符合分子式为C3H8O的醇有三种不同结构
C. 如图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷![]()
D. 治疗疟疾的青蒿素(如图)易溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com