
【题目】下列方程式书写正确的是( )
A.Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.泡沫灭火器的原理:Al3++3HCO3-![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C.HCO3的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的NaOH标准溶液滴定20.00 mL0.1000 mol/L的HCl溶液,滴定曲线如图,下列有关说法正确的是( )
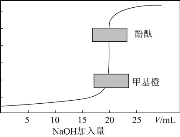
A.指示剂变色时,说明反应的酸、碱恰好等物质的量反应
B.当达到滴定终点时才存在c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.达到滴定终点时,用甲基橙作指示剂消耗NaOH溶液体积比用酚酞多
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,上述滴定恰好中和时,放出114.6J的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,保护环境人人有责。直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A. c(Na+)=2c(SO32-)+c(HSO3-)
B .c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C. c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)氮的氢化物之一肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液,负极的电极反应式是_______________,若使用该电池做电源,惰性电极电解500mL 1mol/L的CuSO4溶液,一段时间后溶液的PH=1,消耗的N2H4质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,由该废料制备的纯度较高的氢氧化镍,工艺流程如下,已知常温下Ksp[Ni(OH)2]=1.0×10-15,则下列说法错误的是( )
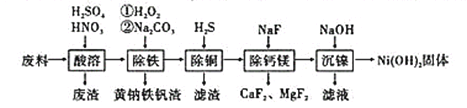
A. 废渣中含有二氧化硅和硫酸钙
B. 加热煮沸可以提高除铁效率
C. 除铜过程中,溶液酸性增强
D. “沉镍”过程中为了将镍沉淀完全,需要调节pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥_____mol/L。
③反应Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式也正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | I-、Cl-、H+、SO42- | NaNO3 | 6I-+2NO3-+8H+=2NO↑+4H2O+3I2 |
B | CO32-、Fe3+、Br-、SO42- | KSCN | 3SCN-+Fe3+ |
C | HClO、Na+、K+、SO32- | CaCl2 | Ca2++ SO32-=CaSO3↓ |
D | K+、Na+、HCO3-、AlO2- | HCl | H++AlO2-+H2O=Al(OH)3↓ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)在实验室中,![]() 可用铁粉和______反应制备,
可用铁粉和______反应制备,![]() 可用铁粉和______反应制备。
可用铁粉和______反应制备。
(2)黄铁矿![]() 主要成分为
主要成分为![]() 是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
![]() ,该过程中若有
,该过程中若有![]()
![]() 参加反应,则反应过程中转移______mol电子。
参加反应,则反应过程中转移______mol电子。
(3)![]() 与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:
与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:![]() ,放电时电池的负极反应式为______;充电时电解液的pH______
,放电时电池的负极反应式为______;充电时电解液的pH______![]() 填“增大”“减小”或“不变”之一
填“增大”“减小”或“不变”之一![]() 。
。
(4)某同学向盛有![]() 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的![]() 溶液,溶液变成棕黄色,发生反应的离子方程式为______;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______
溶液,溶液变成棕黄色,发生反应的离子方程式为______;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______![]() 用平衡移动原理解释
用平衡移动原理解释![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
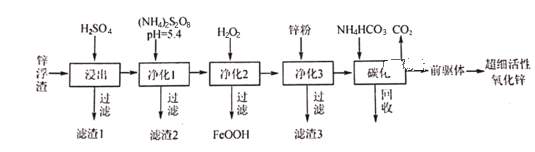
(1)滤渣1的成分为___________。
(2)在S2O82-的结构式中只含有一根“O一O”非极性键,则S的化合价为___________;工业上常用惰性电极电解(NH4)2SO4生产(NH4)2S2O8(过二硫酸铵),阳极电极反应式为__________________。净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:______________________。
(3)净化3的目的_________________________________。
(4)碳化回收溶液的主要成分为___________,该物质循环使用的目的___________________。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃料电池体积小巧、燃料使用便利、洁净环保、理论能量比高,用甲烷燃料电池为下图电解装置供电,工作一段时间后,A池中左右试管收集到的气体体积比为2:1,则:
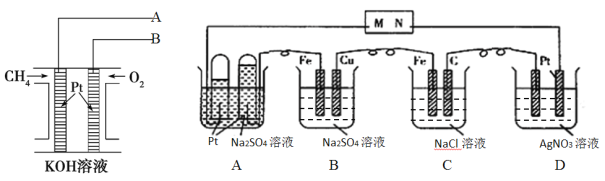
(1)电解一段时间后,甲烷燃料电池中溶液的pH_________。(填“增大、减小或不变”)
(2)甲烷燃料电池中导线A与电解池中的_________(填M或N)导线连接
(3)B池中一段时间后实验现象______________________________________________。
(4)相同条件下,电解质足量的A、B、C、D池中生成气体的总体积由大到小的顺序为_______。
(5)D池电解一段时间后,若要使电解质溶液恢复到电解前的状态,可加入________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com